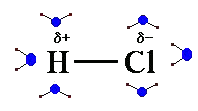| La Dissociazione ionica |
Supponiamo di gettare un piccolo cristallo di NaCl in acqua.
Il cristallo cade sul fondo del recipiente e pian piano si dissolve.
Cosa è accaduto, perchè il cristallo non è più visibile?
C' è ancora, anche se invisibile?
La risposta è no; il cristallo in quanto tale non esiste più: è stato sciolto dall'acqua.
Si ottiene quella che viene chiamata una soluzione liquida, con il sale che funge da soluto.
Dunque, in una soluzione c'è
- il solvente, che è il componente chimico che scioglie;
- il soluto/i soluti, che sono i componenti che vengono disciolti.
Una soluzione può essere: liquida, solida o gassosa, a seconda del suo stato fisico.
Qui ci occuperemo di soluzioni liquide, e in particolare di soluzioni acquose;
di soluzioni, cioè, in cui il solvente è l'acqua.
Tornando al cloruro di sodio lo possiamo immaginare, allo stato solido, come una serie molto grande, dell'ordine di miliardi di miliardi di milioni, di ioni
Na+ Cl-
impacchettati ordinatamente in un Reticolo cristallino tridimensionale; un po' come appare nell'immagine qui a destra. 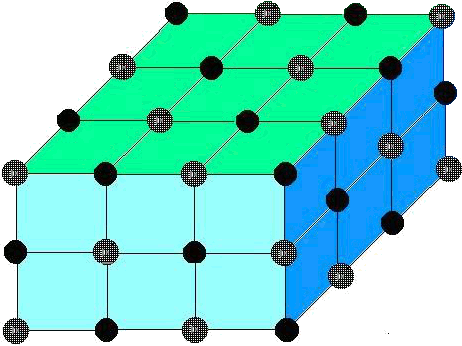
reticolo cristallino
da forze elettriche coulombiane attrattive, interagiscano con le molecole d'acqua (che si comportano da piccoli dipoli elettrici, dotate di estremità di segno opposto), finendo peressere "catturati" dall'attrazione coulombiana con esse
e trascinati via dal reticolo, per essere quindi completamente"incapsulati" e circondati da un certo numero di molecole di solvente,
orientate in modo da presentare verso lo ione l'estremità di segno opposto.Si formano così le
"gabbie di solvatazione" di molecole di solvente,
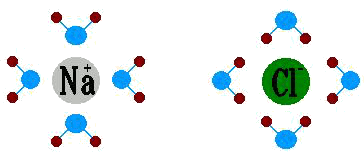
(dette anche sfere di solvatazione) che bloccano i singoli ioni, impedendo loro di ricostruire il reticolo cristallino.Qui di seguito è riportata un' immagine che vuole rappresentare le gabbie di solvatazione degli ioni Na+ e Cl- (gabbie formate da molecole d’acqua)
|
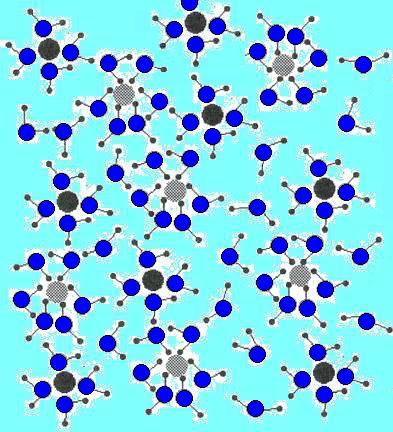
Na+ e Cl- in soluzione acquosa |
| Le molecole del solvente H2O sono orientate in modo da presentare l'ossigeno (estremità δ-) verso lo ione Sodio e gli idrogeni (estremità δ+) verso lo ione Cloro.
Al pari delle sostanze ioniche, anche quelle molecolari possono essere sciolte da un solvente polare come l'acqua; a patto che si tratti di sostanze a loro volta polari.
Si può allora concludere che
Al contrario,
Detto in modo diverso, vige la regola che
|