| Primi modelli atomici di Thomson e Rutherford |
Il Modello Atomico di Thomson fu chiamato Modello dell'Atomo Massiccio |
 |
Era così definito perchè supponeva che la materia fosse formata da atomi pieni, con pochi
spazi vuoti; atomi il cui volume era completamente occupato da una massa di carica positiva, e da elettroni, uniformemente
dispersi nella massa di carica positiva inmaniera da vincere le repulsioni elettrostatiche tra cariche dello stesso segno, tutto
immaginato statico.
|
Era un atomo statico, cioè con la carica positiva e gli elettroni in uno stato di quiete.
|
 |
L'ipotesi di Thomson derivava dalle scoperte da lui stesso fatte e dall'idea
ordinaria che si ha della materia per come ci appare, cioè compatta, consistente e massiccia.
Lo stesso Thomson definì il suo Modello Atomico Modello Atomico a Panettone perchè era costituito da una matrice
(pasta del panettone) di carica positiva che riempiva tutto il volume atomico, all’interno della quale erano distribuite in maniera
uniforme le uvette cioè gli elettroni.
La proposta di Thomson andava però verificata con un esperimento adeguato che
fosse in grado di mostrare chiaramente se il modello dell'Atomo massiccio fosse sostanzialmente accettabile
oppure da sostituire completamente.
|
L'esperienza decisiva scaturì dal lavoro di un gruppo di fisici coordinato da Ernst Rutherford.
|
|
| Il problema da affrontare si poteva riassumere dicendo che in definitiva si doveva bombardare uno strato di
atomi con un fascio di particelle e studiare i risultati del loro reciproco urtarsi.
Il dispositivo sperimentale usato per verificare l'ipotesi di Thomson consisteva
in una sorgente di raggi alfa, una lamina sottilissima d'oro, una lastra fotosensibile ai raggi alfa e quindi in grado di essere da questi impressionata.
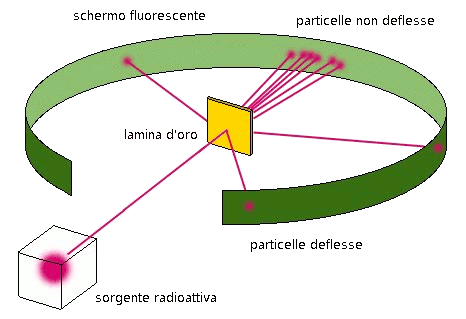
Le condizioni perchè l'esperienza fosse attendibile consistevano soprattutto nel fatto che la lamina metallica doveva essere estremamente sottile e, per questo motivo, ne fu utilizzata una d'oro, metallo malleabile per eccellenza.
Oggi sappiamo che i raggi alfa sono costituiti da nuclei di elio (He), a loro volta formati da due protoni e due neutroni.
Essi (i raggi α) sono ottenibili dal decadimento radioattivo naturale di alcuni elementi pesanti come, ad esempio, il Radio-226(Ra226).
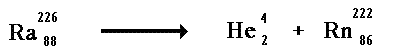
La sorgente di raggi α era costituita da una camera a pareti di piombo contenente una certa quantita' di Radio, con un piccolo foro praticato su una delle pareti per
permettere la fuoriuscita del raggio α.
I risultati dell'esperienza di Rutherford contrastavano radicalmente col modello atomico elaborato da Thomson.
|
|
| 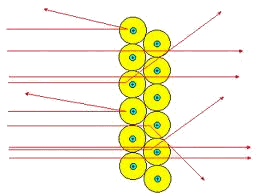 |
| La maggior parte delle particelle α(alfa), circa il 99% del totale, attraversava indisturbata la lamina: il modello di Thomson prevedeva una cosa del genere, anzi prevedeva che il 100% proseguisse indisturabata; il 1% subiva
una deviazione più o meno accentuata, e solo una particella su 8000 tornava indietro con grande energia cinetica: questi
ultimi 2 dati erano in disaccordo con il modello di Thomson.
Rutherford, ragionando a lungo sui risultati, si rese pian piano
conto che l’unico modello coerente con essi era quello dell’atomo nucleare a nucleo positivo puntiforme nel quale era
concentrata tutta la massa atomica; questo perché: |
|
|
- se il 99% di particelle passava indisturbato, era perché trovava ampi spazi vuoti
- 1% deviato ai piccoli angoli, si riferiva alle particelle alfa che passavano vicino al nucleo positivo; e la loro % ridotta faceva pensare che il nucleo fosse piccolo;
- 1 su 8000 (pochissime, e questo confermava la piccolezza del nucleo) rimbalzava indietro con grande energia come se avesse urtato contro un nucleo piccolo ma di grande massa, cioè con tutta la massa atomica lì concentrata.
| 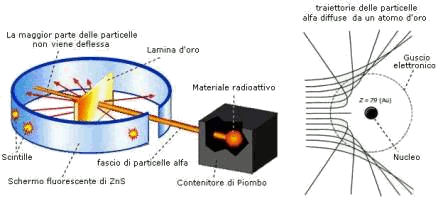
| I risultati dunque erano in accordo con un modello atomico fatto di enormi spazi vuoti, in cui la materia è confinata in una regione centrale estremamente piccola rispetto all'atomo (il nucleo); in questo nucleo,
da considerarsi puntiforme, infatti risultava concentrata tutta la massa dell’atomo (scattering ai grandi angoli).
Da uno studio accurato dei risultati, Rutherford concluse che la carica positiva e tutta la massa atomica occupano un volume ridottissimo in un nucleo centrale attorno al quale ruotano a grande distanza gli elettroni.
|
Questo modello prese il nome di Atomo di Rutherford o Modello Atomico Planetario o anche Modello Atomico Nucleare.
Il modello di Thomson veniva così rapidamente superato.
Due anni dopo la formulazione da parte di Rutherford del modello atomico nucleare veniva scoperta l’esistenza del protone, particella di carica positiva residente nel nucleo dell’atomo.
In seguito, nel 1932 fu la volta della scoperta del neutrone e così la composizione del Nucleo Atomico era completamente chiarita.
Pagina Web elaborata da Patrik Loi, classe 2.C ITIS, e prof. C. Strusi per l'Attività Laboratoriale "Chimica & Web", A.S. 2013/2014
|
| |