| Struttura elettronica dell'atomo |
Quando si parla di struttura dell’atomo, in chimica, ci si riferisce esclusivamente alla sua struttura elettronica, e quindi riguarda i soli elettroni. La chimica infatti, fatta eccezione per la Chimica nucleare, si occupa di reazioni (chimiche, appunto) che coinvolgono esclusivamente gli elettroni.
Questo significa, come già detto, che
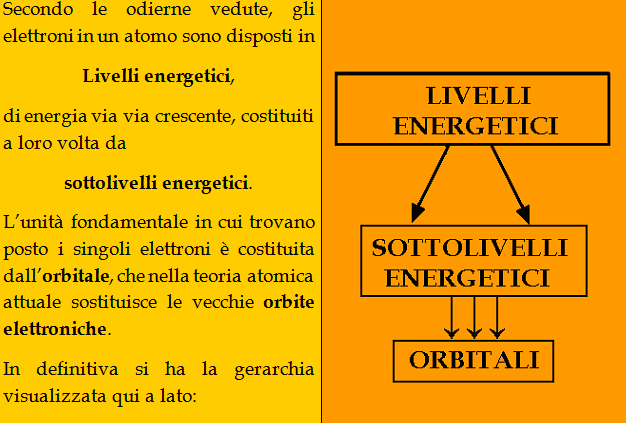
ogni livello energetico è costituito da uno o più sottolivelli
e in ogni sottolivello ci sono uno o più orbitali.
e in ogni sottolivello ci sono uno o più orbitali.
Negli orbitali trovano posto gli elettroni dell’atomo.
| La domanda che viene in mente è: quanti sono i livelli energetici? |
La teoria risponde che in linea di principio in un atomo ci sono infiniti livelli.
Per distinguerli, si numerano partendo da 1.
È più esatto dire che:
ogni livello energetico è contraddistinto dal valore che assume il suo
| Numero quantico principale n. |
Il 1° livello energetico è contraddistinto da n = 1; il primo livello elettronico si trova più vicino al nucleo;
Il 2° livello energetico è contraddistinto da n = 2;
Il 3° livello energetico è contraddistinto da n = 3;
Il 4° livello energetico è contraddistinto da n = 4;
e così via…
Più alto è il valore del numero quantico principale del livello energetico e più lontano il livello si trova dal nucleo.
Anche se la teoria atomica afferma che i livelli energetici di un atomo sono infiniti, in pratica si considerano solo i primi 7, e tra poco vedremo perché…
Che cosa ci dice la teoria per quanto riguarda i possibili sottolivelli energetici? Anche per essi la teoria sostiene che sono infiniti; per la stessa ragione per cui ci si limita ai primi 7 livelli, in pratica si considerano solo 4 distinti sottolivelli.
I sottolivelli vengono contraddistinti da lettere; i 4 sottolivelli che considereremo sono indicati dalle lettere:
| s, p, d, f |
Si hanno le seguenti proprietà
| 1s |
| 2s 2p |
| 3s 3p 3d |
| 4s 4p 4d 4f |
| 5s 5p 5d 5f |
C’è anche il sottolivello 5g che però non si considera perchè resta vuoto e quindi ai fini della struttura elettronica di un atomo è come se non ci fosse.
| 6s 6p 6d |
Ci sono altri 3 sottolivelli che però restano sempre vuoti.
| 7s 7p |
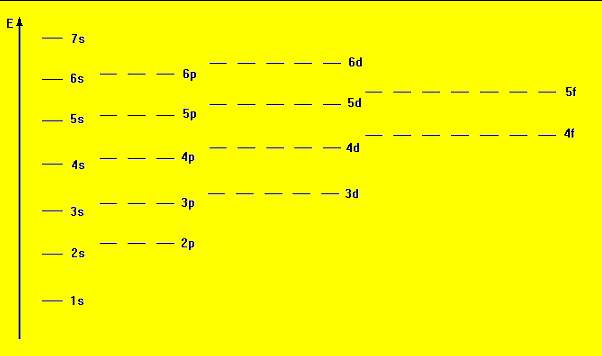
In definitiva si ha la seguente successione di livelli, sottolivelli ed orbitali:

In questa successione, dunque, sono indicati solo gli orbitali che vengono effettivamente riempiti.
Questa successione è molto importante per scrivere la:
| Configurazione elettronica |
di un elemento.
Si ha dunque il seguente grafico, dove in ordinate compare l'energia:
Determinata la sequenza di livelli e sottolivelli, occorre conoscere alcune informazioni essenziali per poter mettere gli elettroni in ogni livello, sottolivello ed orbitale. Dunque, è necessario sapere
|
La risposta all’ultima domanda sembrerebbe essere che l’ordine di riempimento consista nel riempire un livello dopo l’altro:
cioè prima di procedere al riempimento del successivo livello, occorre riempire completamente quello in cui ci si è trova; in
realtà si vedrà che non è sempre così.
Per rispondere alla seconda domanda, vale il
|
IL PRINCIPIO DI ESCLUSIONE DI PAULI |
Il Principio di Esclusione di Pauli è di fondamentale importanza per poter scrivere la configurazione elettronica
di un elemento; esso, infatti, permette di stabilire quanti elettroni possono essere collocati in un singolo orbitale.
Si può enunciare così:
|
In un orbitale dell'atomo di un elemento possono essere sistemati al massimo due elettroni di spin opposto. oppure Gli elettroni di uno stesso orbitale devono avere per forza spin opposto e quindi possono essere al massimo 2 per orbitale. |
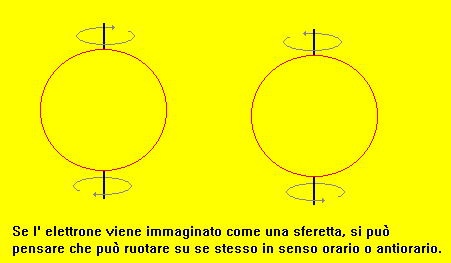
Che cos'è però lo spin?
Se l'elettrone è visualizzato come una sferetta, essa può essere immaginata rotante su se stessa in due versi:
uno orario e l'altro antiorario; ad un verso si assegna spin negativo e all'altro spin positivo.
|
Quindi un orbitale può essere vuoto, contenere un elettrone o, al massimo, due; non esistono altre possibilità. |
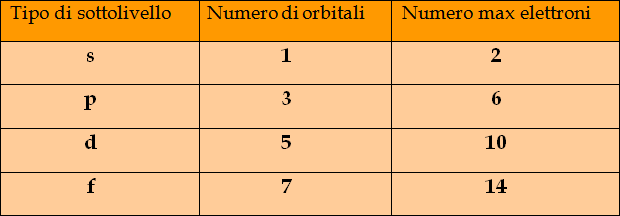
L’altra domanda riguardava quanti orbitali ci sono in ogni sottolivello.
A questo proposito è necessario dire che la risposta scaturisce da considerazioni complesse di natura matematica sull’equazione di Schroedinger.
Ai fini di questo corso, vale la seguente tabella che stabilisce quanti orbitali ci sono in ogni tipo di sottolivello e quanti elettroni complessivamente possono trovare posto in ognuno di essi.
Con le informazioni acquisite, si possono scrivere le più semplici CONFIGURAZIONI ELETTRONICHE
quelle degli elementi chimici con bassi valori di Numero Atomico Z.
Si ha:
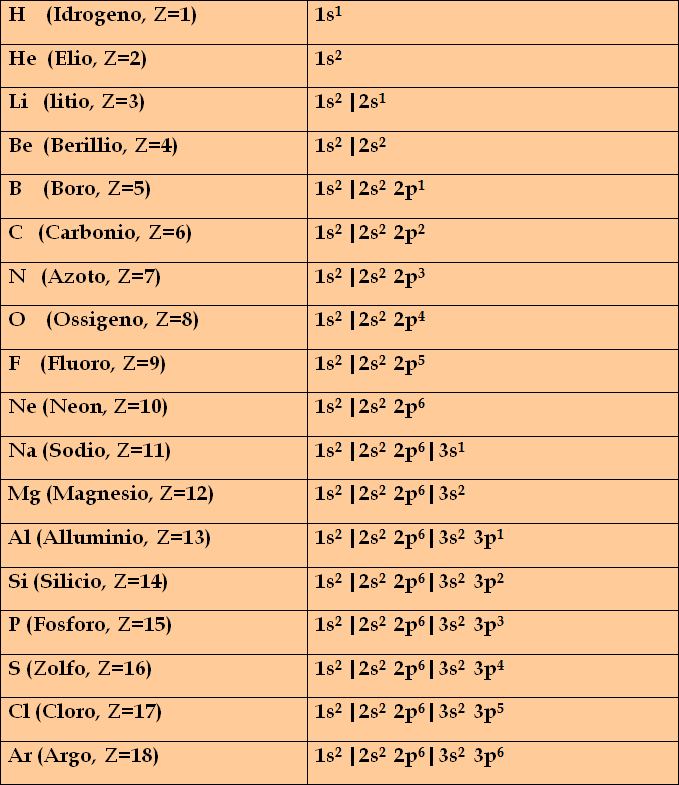
Si vede che il riempimento avviene sequenzialmente, livello dopo livello.
Con l’elemento n° 19, cioè con il K (Potassio, Z=19) accade un fatto nuovo, infatti la sua configurazione è:
K (Potassio, Z=19) 1s2 |2s2 2p6|3s2 3p6 4s1
quindi il diciannovesimo elettrone va nel sottolivello 4s e non, come ci si aspettava, nel 3d.
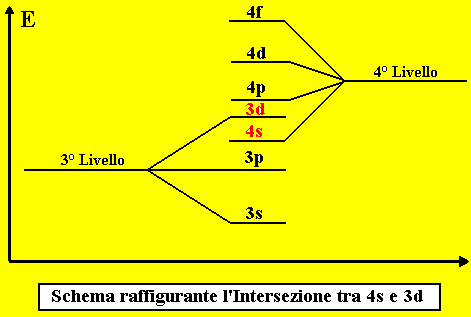
Si è arrivati alla prima di una serie di INTERSEZIONI di LIVELLO.
che significa ciò?
Significa che il primo sottolivello (il 4s) del 4° Livello viene prima dell’ultimo sottolivello
(il 3d) del 3° Livello, e quindi il 4s si riempie prima del 3d; per questo motivo si dice che
il 4s e il 3d sono intersecati.
Il fenomeno si chiama Intersezione tra livelli.
Ovviamente a questo punto è facile dedurre che il 20° elettrone, per il Ca (Calcio, Z=20) completerà il 4s:
Ca (Calcio, Z=20) 1s2 |2s2 2p6|3s2 3p6 4s2
Solo dopo si comincerà a riempire il 3d, con il 21° elettrone:
Sc (Scandio, Z=21) 1s2 |2s2 2p6|3s2 3p6 4s2 3d1
Riempimento che proseguirà con i successivi elementi:
Ti (Titanio, Z=22) 1s2 |2s2 2p6|3s2 3p6 4s2 3d2
V (Vanadio, Z=23) 1s2 |2s2 2p6|3s2 3p6 4s2 3d3
Saltando per brevità al Ferro:
Fe (Ferro, Z=26) 1s2 |2s2 2p6|3s2 3p6 4s2 3d6
Il riempimento del 3d proseguirà e si completerà con Rame e Zinco:
Cu (Rame, Z=29) 1s2 |2s2 2p6|3s2 3p6 4s2 3d9
Zn (Zinco, Z=30) 1s2 |2s2 2p6|3s2 3p6 4s2 3d10
A questo punto, accade ancora un fatto nuovo: con il 31° elettrone si ristabilisce la giusta sequenza, nel senso che il 3d torna più in basso, energeticamente parlando, del 4s e quindi l’intersezione scompare; si dirà che “l’intersezione è stata superata”
Ga (Gallio, Z=31) 1s2 |2s2 2p6|3s2 3p6 3d10|4s2 4p1
Riassumendo: l’intersezione si manifesta con K (Z=19), resta per tutto il riempimento del 3d e viene superata solo quando,completato il 3d, c’è un elettrone da mettere nel 4p; si può allora dire che la condizione di superamento dell’Intersezione implica avere a disposizione almeno 13 elettroni perchè,
per superare l’intersezione, è stato necessario riempire il 4s2, riempire il 3d10 ed avere 1 elettrone da mettere nel 4p1; la condizione di superamento si scrive:
4s2 3d10 4p1
Dunque la condizione di superamento dell’intersezione prevede
il riempimento completo dei due sottolivelli intersecati, e di avere almeno un elettrone da mettere nel sottolivello successivo.
La domanda a questo punto è: quante intersezioni ci sono e come è possibile prevederle?
Fermo restando che
una Intersezione si manifesta quando prima di completare il riempimento di un livello, si passa a quello successivo;
per poter prevedere tutte le Intersezioni che è possibile avere, considerando uno qualunque dei NOVANTADUE elementi naturali, è stata elaborata una regola rappresentabile graficamente e chiamata
La REGOLA della DIAGONALE
Essa altro non è che una rappresentazione grafica chiara ed evidente dell’ordine esatto di riempimento dei vari livelli e sottolivelli:
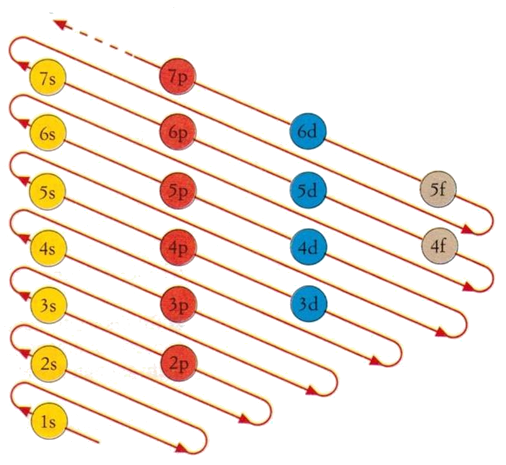
Un modo diverso e forse più semplice di rappresentrarla è il seguente
|
|
È facile rendersi conto che per il riempimento dei primi sottolivelli, da 1s fino a 3p, si procede regolarmente, livello dopo livello; successivamente si comincia, come già visto, con la prima Intersezione tra 4s e 3d, e poi graficamente appare una serie di diagonali (come percorso di riempimento) ognuna delle quali corrisponde a delle Intersezioni; ogni volta che ci si trova davanti ad una intersezione, bisogna discuterla per vedere se c’è un numero sufficiente di elettroni per poterla superare. |
|
Qui sulla destra si ha una rappresentazione dei vari livelli e sottolivelli nell’ordine in cui si trovano lungo una scala arbitraria di energie potenziali crescenti, almeno finchè le Intersezioni sono operanti; cioè finchè non vengono superate. |
|
Utilizzando allora la Regola della Diagonale, è possibile scrivere la Configurazione Elettronica di un elemento qualunque,
con l’avvertenza che al momento di scriverla occorre discutere una per una tutte le Intersezioni di Livello incontrate,
allo scopo di capire, per ognuna di esse, se ci sono le condizioni perchè siano superate oppure no.
Facciamo almeno un esempio, e consideriamo per questo l’elemento Radio:
Ra (Radio, Z=88)
Iniziamo a scrivere la Configurazione Elettronica guardando passo passo la Regola della Diagonale; chiaro che per i primi sottolivelli non ci sono problemi,
dato che il riempimento avviene nell’ordine sequenziale previsto, livello dopo livello:
Ra (Radio, Z=88) 1s2 |2s2 2p6|3s2 3p6
Arrivati a questo punto, sono stati sistemati 18e- (elettroni), ne sono rimasti 70 e ci troviamo di fronte la prima intersezione 4s 3d; la condizione per il suo superamento si scrive:
4s2 3d10 4p1
ed implica l’impiego di 13e- ; dal momento che ce ne sono ancora 70, la cosa è fattibile, l’intersezione cioè è superata, il 3d torna al posto suo e si completa il 3° livello:
Ra (Radio, Z=88) 1s2 |2s2 2p6|3s2 3p6 3d10|
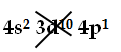
Riempito il 3d, restano 60e- e possono essere riempiti anche il 4s e il 4p, dal momento che appartengono entrambi allo stesso livello, il 4° (e quindi non sono intersecati):
Ra (Radio, Z=88) 1s2 |2s2 2p6|3s2 3p6 3d10|4s2 4p6
in questo modo siamo arrivati a riempire fino al 4p e restano 52e- .
Guardando la Regola delle Diagonali, si osserva che dal 4p occorre salire al 5s, quindi siamo di fronte ad un’altra intersezione tra 5s e 4d; in questo caso la condizione di superamento si scrive:
5s2 4d10 5p1
e ancora una volta implica l’impiego di 13e- ; dal momento che ce ne sono ancora 52, anch’essa è superata e il 4d può andare al suo posto:
Ra (Radio, Z=88) 1s2 |2s2 2p6|3s2 3p6 3d10|4s2 4p6 4d10
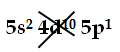
Riempito il 4d, restano 42e- e possono essere riempiti anche il 5s e il 5p, dal momento che sono sottolivelli non intersecati dello stesso livello (il 5°):
Ra (Radio, Z=88) 1s2 |2s2 2p6|3s2 3p6 3d10|4s2 4p6 4d10 5s2 5p6
E così restano 34e- e la regola diagonale indica che occorre salire al 6s, incontrando un’altra intersezione tra 6s e 4f, con la condizione di superamento che si scrive
6s2 4f14 5d1
implicando l’utilizzo di 17e- ; dal momento che ne abbiamo ancora 34, ci sono le condizioni di superamento dell’intersezione, con il 4f che va al posto suo, prima dei sottolivelli già riempiti 5s e 5p:
Ra (Radio, Z=88) 1s2 |2s2 2p6|3s2 3p6 3d10|4s2 4p6 4d10 4f14|5s2 5p6
In questo modo si completa anche il 4° livello e restano 20e- ; sistemato il 4f, dell’intersezione discussa restano i sottolivelli 6s e 5d che sono a loro volta intersecati,
dando luogo ad altra intersezione, che va discussa, aggiungendo come 3° sottolivello il 6p:
6s2 5d10 6p1
il superamento di quest’ultima intersezione richiede evidentemente 13e-.
Dal momento che di elettroni ce ne sono ancora 20, anche questa intersezione è superata, consentendo il riempimento del 5d:
Ra (Radio, Z=88) 1s2 |2s2 2p6|3s2 3p6 3d10|4s2 4p6 4d10 4f14|5s2 5p6 5d10
restano poi 10e- e i sottolivelli 6s e 6p
che possono essere riempiti perché non intersecati, in quanto appartenenti allo stesso 6° livello:
Ra (Radio, Z=88)
in tal modo restano solo 2 elettroni che vanno evidentemente nel 7s, consentendo di completare la configurazione elettronica del Radio:
Ra (Radio, Z=88)
Questa discussione completa effettuata dovrebbe servire a comprendere in che modo si procede per scrivere le configurazioni elettroniche applicando la regola della diagonale.
Quindi:
Per esempio, nei casi seguenti si vede facilmente che la configurazione elettronica esterna è data da ciò che è stato sottolineato ed evidenziato con un colore del carattere diverso dal nero:
Si può osservare che le configurazioni elettroniche esterne sono di 2 tipi, a seconda che siano composte da sottolivelli intersecati (es. quella del Ferro 4s2 3d6) oppure no.
In base alla configurazione elettronica esterna, gli elementi sono riuniti in gruppi chimici; e quindi diremo che
Configurazione elettronica Esterna Configurazione elettronica esterna generale.
I gruppi chimici di cui si approfondisce lo studio e la composizione in termini di elementi costituenti sono quelli di tipo A. numero TOTALE di elettroni esterni Configurazione elettronica esterna
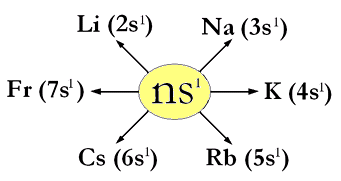
Dove quelle evidenziate in giallo sono le configurazioni elettroniche esterne, dalle quali si vede che si tratta degli elementi del 1° gruppo di tipo A, perchè sono tutti rappresentati dalla configurazione esterna
generale ns1, avendo tutti un solo elettrone esterno in un orbitale di tipo s.
Si può dire quindi che la configurazione elettronica esterna generale degli elementi del gruppo 1°A è
ns1, dove n può assumere i valori 2, 3, 4, 5, 6, 7.
Dove quelle evidenziate in giallo sono le configurazioni elettroniche esterne, dalle quali si vede che si tratta degli elementi del 2° gruppo di tipo A, perchè sono tutti rappresentati dalla configurazione esterna
generale ns2, avendo tutti due elettroni esterni in un orbitale di tipo s.
Si può dire quindi che la configurazione elettronica esterna generale degli elementi del gruppo 2°A è ns2, dove n può assumere i valori 2, 3, 4, 5, 6, 7.
E per i gruppi A successivi ? Beh, in essi si avrà, nella configurazione elettronica esterna, il progressivo riempimento degli orbitali di tipo p, passando da un gruppo all'altro; cosí è facile rendersi conto che:
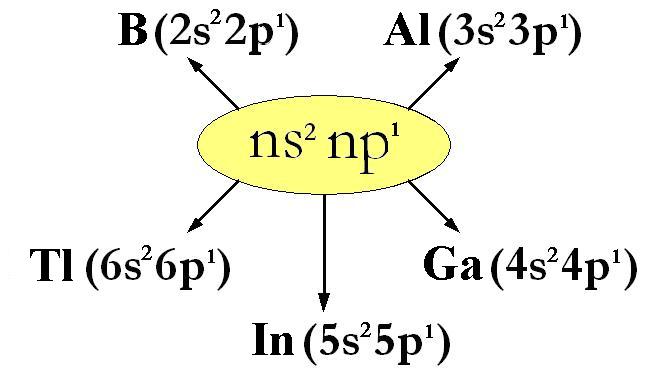
sono gli elementi del gruppo 3° A, la cui configurazione elettronica esterna ha formula generale ns2 np1 dove n può andare da 2 a 6;
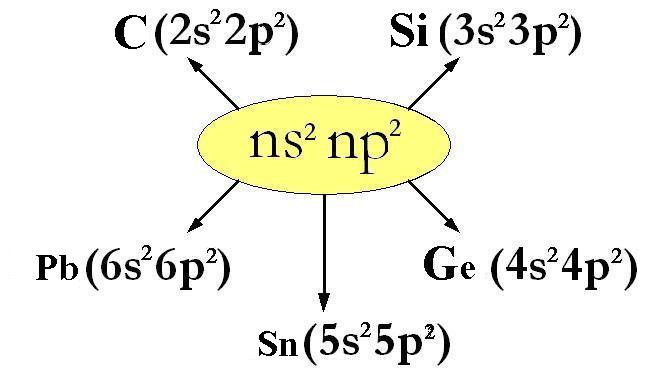
sono esempi di elementi del gruppo 4° A, la cui configurazione elettronica esterna ha formula generale ns2 np2 dove n può andare da 2 a 6;
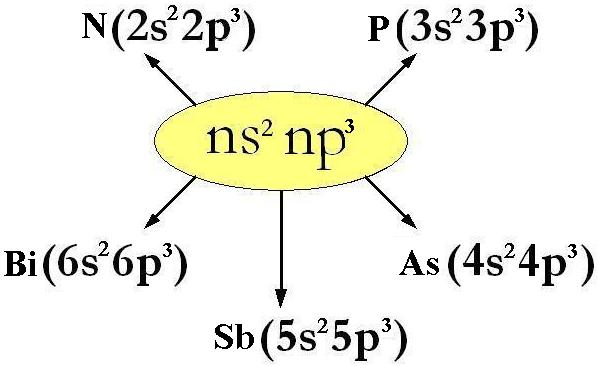
sono gli esempi di elementi del gruppo 5° A, la cui configurazione elettronica esterna ha formula generale ns2 np3 dove n può andare da 2 a 6;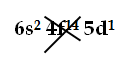
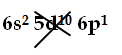
1s2 |2s2 2p6|3s2 3p6 3d10|4s2 4p6 4d10 4f14|5s2 5p6 5d10 6s2 6p6
1s2 |2s2 2p6|3s2 3p6 3d10|4s2 4p6 4d10 4f14|5s2 5p6 5d10 6s2 6p6 7s2
Ricordiamo che lo scopo della trattazione che si sta affrontando, è quello di arrivare a spiegare come i vari elementi possano formare legami chimici e perché alcuni non sono in grado di farlo.
Così, una volta che si è in grado di scrivere la configurazione elettronica, si passa alla questione successiva che riguarda la determinazione della CONFIGURAZIONE ELETTRONICA ESTERNA.
Data la Configurazione Elettronica di un elemento, si definisce Configurazione Elettronica Esterna la parte di configurazione elettronica che si riferisce al livello più esterno occupato da elettroni.
Per la sua determinazione si procede nel modo seguente:
una volta scritta la configurazione elettronica, si cerca il valore massimo del numero quantico principale, la prima volta che compare, se è presente due volte, e si immagina di sottolineare la parte di configurazione elettronica da quel punto verso destra: tutto quello che viene sottolineato fa parte della configurazione elettronica esterna.
La configurazione elettronica esterna di un elemento è rappresentata dagli elettroni dell'ultimo livello energetico occupato e da come sono in esso distribuiti.

Nel primo caso (quando i sottolivelli sono intersecati) si tratta di un elemento di tipo B; nel secondo caso si tratta di un elemento di tipo A.
Se dunque i sottolivelli che fanno parte della configurazione elettronica esterna sono intersecati (i valori del numero quantico principale sono diversi) l’elemento chimico è di tipo B;
al contrario se non sono intersecati (i valori del numero quantico principale sono uguali), l’elemento è di tipo A.
Due elementi appartengono allo stesso gruppo chimico se la loro
diversamente sarà un gruppo chimico di tipo B o con sottolivelli esterni intersecati.
Allora i gruppi chimici di tipo A sono 8 (otto) e l’appartenenza al gruppo si stabilisce contando il
Per capire meglio, consideriamo i seguenti esempi:
Li (Litio, Z=3) : 1s2 | 2s1
Na (Sodio, Z=11) : 1s2 | 2s2 2p6 | 3s1
K (Potassio, Z=19) : 1s2 | 2s2 2p6 | 3s2 3p6 4s1
Rb (Rubidio, Z=37) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 5s1
Cs (Cesio, Z=55) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 5s2 5p6 6s1
Fr (Francio, Z=87) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 5s2 5p6 6s2 6p6 7s1
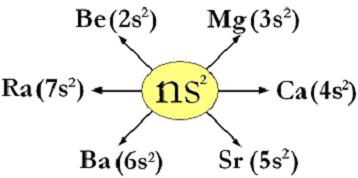
Riassuntivamente per il gruppo 1°A si ha:
Cosí avremo:
Be (Berillio, Z=4) : 1s2 | 2s2
Mg (Magnesio, Z=12) : 1s2 | 2s2 2p6 | 3s2
Ca (Calcio, Z=20) : 1s2 | 2s2 2p6 | 3s2 3p6 4s2
Sr (Stronzio, Z=38) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 5s2
Ba (Bario, Z=56) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 5s2 5p6 6s2
Ra (Radio, Z=88) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 5s2 5p6 6s2 6p6 7s2
Riassuntivamente per il gruppo 2°A si ha:
B (Boro, Z=5) 1s2 | 2s2 2p1
Al (Alluminio, Z=13) 1s2 | 2s2 2p6 | 3s2 3p1
Ga (Gallio, Z=31) 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p1
In (Indio, Z=49) 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 5s2 5p1
Tl (Tallio, Z=81) 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 4f14| 5s2 5p6 5d10 6s2 6p1
C (Carbonio, Z=6) : 1s2 | 2s2 2p2
Si (Silicio, Z=14) : 1s2 | 2s2 2p6 | 3s2 3p2
Ge (Germanio, Z=32) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p2
Sn (Stagno, Z=50) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 5s2 5p2
Pb (Piombo, Z=82) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 4f14| 5s2 5p6 5d10 6s2 6p2
N (Azoto, Z=7) : 1s2 | 2s2 2p3
P (Fosforo, Z=15) : 1s2 | 2s2 2p6 | 3s22p3
As (Arsenico, Z=33) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p3
Sb (Antimonio, Z=51) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 5s2 5p3
Bi (Bismuto, Z=83) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 4f14| 5s2 5p6 5d10 6s2 6p3
|
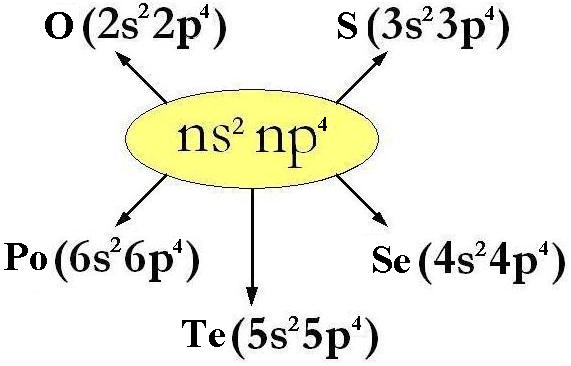
O (Ossigeno, Z=8) : 1s2 | 2s2 2p4 S (Zolfo, Z=16) : 1s2 | 2s2 2p6 | 3s22p4 Se (Selenio, Z=34) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p4 Te (Tellurio, Z=52) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 5s2 5p4 Po (Polonio, Z=84) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 4f14| 5s2 5p6 5d10 6s2 6p4 |
sono gli esempi di elementi del gruppo 6° A, la cui configurazione elettronica esterna ha formula generale ns2 np4 dove n può andare da 2 a 6;
|
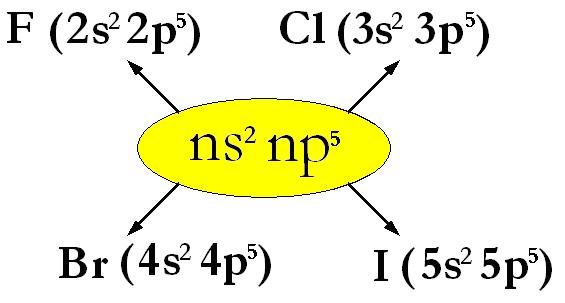
F (Fluoro, Z=9) : 1s2 | 2s2 2p5 Cl (Cloro, Z=17) : 1s2 | 2s2 2p6 | 3s22p5 Br (Bromo, Z=35) :1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p5 I (Iodio, Z=53) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 5s2 5p5 At (Astato, Z=85) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 4f14| 5s2 5p6 5d10 6s2 6p5 |
sono gli esempi di elementi del gruppo 7° A, la cui configurazione elettronica esterna ha formula generale
ns2 np5 dove n può andare da 2 a 6;
|
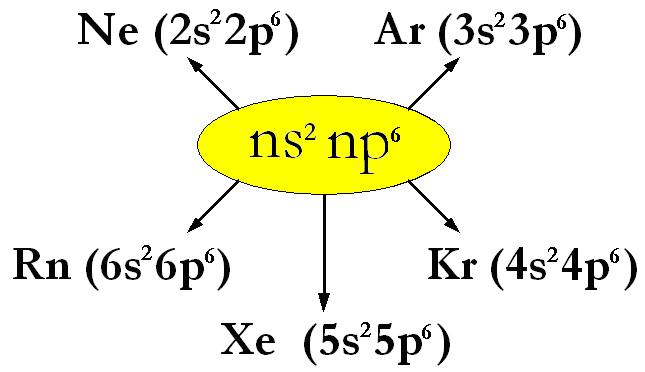
Ne (Neon, Z=10) : 1s2 | 2s2 2p6 Ar (Argo, Z=18) : 1s2 | 2s2 2p6 | 3s22p6 Kr (Kripton, Z=36) :1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 Xe (Xenon, Z=54) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 5s2 5p6 Rn (Radon, Z=86) : 1s2 | 2s2 2p6 | 3s2 3p6 3d10| 4s2 4p6 4d10 4f14| 5s2 5p6 5d10 6s2 6p6 |
Riassuntivamente per il gruppo 8°A si ha:
Realizzato a cura di Michele Alibrandi (classe 2A ITIS Ferracciu di Tempio Pausania) e prof. Strusi; A.S. 2013/2014

