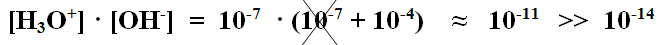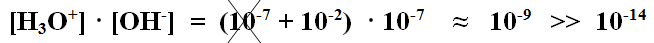La risposta è che anche in acqua pura si forma una certa quantità di ioni, anche se questa quantità è piccola, anzi piccolissima. Gli ioni derivano dalla autodissociazione ionica
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
In termini stechiometrici si ha:
ma la cosa più importante è che la quantità di ioni idrogeno e ossidrili è molto piccola in acqua pura. Vediamo di capire meglio che succede e di che quantità si sta parlando. In 1 litro di acqua pura ci sono, come sappiamo, 1000 grammi di acqua, dal momento che la densità di essa è 1000 grammi/litro; questi 1000 grammi a quante moli corrispondono? Le moli si possono calcolare:
contenute in 1 litro. Di queste 55,6 moli di acqua quante subiscono autodissociazione? La risposta è 10-7 moli di acqua (per litro, dato ricavato sperimentalmente) Si ha dunque
E quindi si può dire che in acqua pura l' autodissociazione produce una concentrazione di 10-7 moli/l di H3O+ e 10-7 moli/l di OH- Si ha dunque
Si definisce Prodotto ionico Kw dell'acqua, dato da
In realtà questa è una reazione di equilibrio e come tale è regolata dalla legge di Gouldberg e Waage sugli equilibri chimici. Come si sa, la legge di G. & W. si scrive, data una generica reazione di equilibrio:
con il significato che a moli di A, reagendo con b moli di B danno c moli di C e d moli di D. Una reazione del genere è regolata dalla costante Keq data da
Nel nostro caso la reazione di equilibrio è:
o anche:
Ora il valore di [H2O]2 l' abbiamo già visto essere uguale a (55,6 moli/Litro)2 ed è praticamente costante perchè solo circa 10-7 moli/Litro di acqua si dissociano, cioè pochissime; per cui il valore di [H2O] 2 lo possiamo inglobare nella costante e scrivere:
Se il prodotto a primo membro lo indichiamo con una nuova costante KW, chiamata Prodotto ionico dell'acqua, cioè se poniamo
Allora risulta:
E quindi risulta che KW è il prodotto della concentrazione molare di ioni H3O+ per la concentrazione molare degli ioni OH-. Sperimentalmente si trova che esso è a 25°C uguale a 10-14, poichè risulta che a questa temperatura
A questo punto però occorre dire che le cose funzionano in modo tale che,
cioè
Per capire bene le implicazioni di tutto questo, facciamo un esempio, supponendo di aggiungere ad un litro di acqua 10-4 moli di NaOH, idrossido di sodio. Tutto l'idrossido di sodio si scinde in ioni, secondo la seguente reazione:
In seguito a questa dissociazione in ioni, si formano 10-4 moli di ioni OH-, quindi le concentrazioni di ioni in soluzione diventano:
Cioè, alle concentrazioni presenti in acqua si sono aggiunte 10-4 moli di ioni OH-, in queste condizioni il prodotto delle concentrazioni risulta
Il prodotto delle concentrazioni è circa uguale a 10-11 (1000 volte + grande di 10-14) perchè 10-7 è trascurabile rispetto a 10-4. Allora il sistema reagisce in modo da riportare il prodotto delle due concentrazioni uguale a KW; possiamo dire, allora, che, in seguito a questa reazione del sistema acquoso, le concentrazioni diventano:
Se pongo
Si ottiene
Dove il valore della variabile (incognita) y deve essere tale che il prodotto delle concentrazioni torni a essere uguale a 10-14:
E' facile rendersi conto che nell'espressione 10-4 + y il termine y è trascurabile rispetto a 10-4, essendo molto più piccolo di 10-7; risulta cioè chiaramente che
per cui si può porre, approssimando, che
con questa ipotesi, l'espressione precedente del Prodotto Ionico KW diventa:
Si ha cioè la seguente equazione di 1°grado:
dove risulta essere anche
cioè
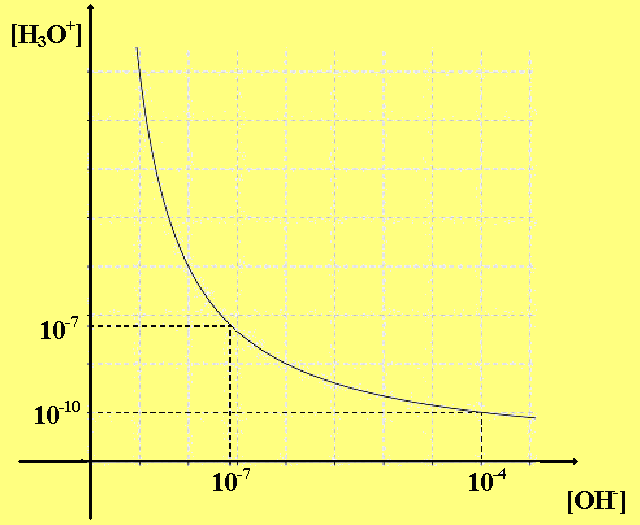
e quindi [H3O+] = 10-10 e siccome abbiamo detto essere [OH-] = 10-4 ne consegue che
cioè il prodotto delle concentrazioni è tornato uguale a KW, in seguito alla reazione del sistema. Questo significa che le 2 concentrazioni sono inversamente proporzionali: se una cresce, l'altra deve diminuire in modo tale che il loro prodotto resti sempre uguale a 10-14.
Allo stesso modo facciamo un esempio, supponendo di aggiungere ad un litro di acqua 10-2 moli di un acido, per es. acido nitrico HNO3. Tutto l'acido si scinde in ioni, secondo la seguente reazione:
In seguito a questa dissociazione, si formano 10-2 moli di ioni H3O+; quindi le concentrazioni di ioni in soluzione diventano:
Cioè, alle concentrazioni presenti in acqua si sono aggiunte 10-2 moli/L di ioni H3O+, in queste condizioni il prodotto delle concentrazioni risulta
Il prodotto delle concentrazioni è circa uguale a 10-9 (100000 volte + grande di 10-14) perchè 10-7 è trascurabile rispetto a 10-2. Allora il sistema reagisce in modo da riportare il prodotto delle due concentrazioni uguale a KW; possiamo dire, allora, che, in seguito a questa reazione del sistema acquoso, le concentrazioni diventano:
Se pongo
Si ottiene
Dove il valore della variabile (incognita) y deve essere tale che il prodotto delle concentrazioni torni a essere uguale a 10-14:
E' facile rendersi conto che nell'espressione 10-2 + y il termine y è trascurabile rispetto a 10-2, essendo molto più piccolo di 10-7; risulta cioè chiaramente che
per cui si può porre, approssimando, che
con questa ipotesi, l'espressione precedente del Prodotto Ionico KW diventa:
Si ha cioè la seguente equazione di 1°grado:
dove risulta essere anche
cioè
e quindi [OH-] = 10-12 e siccome abbiamo detto essere [H3O+] = 10-2 ne consegue che
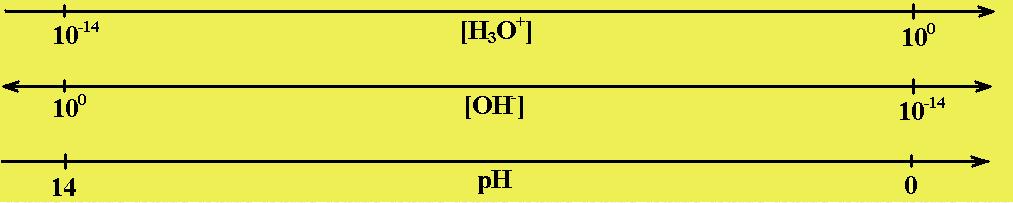
cioè il prodotto delle concentrazioni è tornato uguale a KW, in seguito alla reazione del sistema. Questo significa che le 2 concentrazioni sono inversamente proporzionali: se una cresce, l'altra deve diminuire in modo tale che il loro prodotto resti sempre uguale a 10-14. Quanto visto, succede sempre se aggiungiamo un acido o una base ad acqua pura. Per riassumere quanto detto, ponendo l'accento su come varia e sul campo di variabilità della concentrazione ioni idrogeno[H3O+] , possiamo concludere quanto segue: la concentrazione [H3O+] , da innumerevoli prove effettuate, può raggiungere un minimo, in soluzione acquosa pari a 10-14, questo si può realizzare con grosse aggiunte di una sostanza basica, tipo NaOH; mentre al contrario può raggiungere un massimo pari a 1 (il numero 1 si può esprimere anche come 100, cioè 10 elevato a zero), per aggiunte di una sostanza acida, tipo HCl; in definitiva il campo di variabilità è dato da:
o, che è la stessa cosa:
Di conseguenza anche la concentrazione degli OH- varia allo stesso modo , ma inversamente, per cui quando gli [H3O+] sono 10-14 moli/Litro, gli [OH-] sono 1 mole/Litro, mentre se gli [H3O+] sono 1 moli/Litro, gli [OH-] sono 10-14
Il pH è un altro modo usato per misurare l'acidità o la basicità di una soluzione. Se consideriamo la concentrazione idrogenionica di una soluzione acquosa, si è detto che essa può variare nell'intervallo definito da
Se a questo punto considero gli esponenti delle potenze in base dieci che sono estremi dell’intervallo suddetto e questo esponente cambiato di segno della concentrazione idrogenionica di una soluzione lo chiamo pH, si vede facilmente che il pH di una soluzione può variare nell’intervallo
e precisamente si ha
e di conseguenza l’acidità, basicità e neutralità di una soluzione si può esprimere in funzione del pH, dicendo che
|
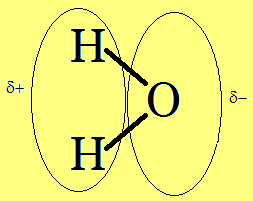
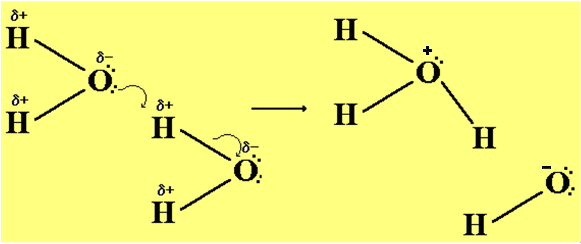
 H3O+ + OH-
H3O+ + OH-  cC + dD
cC + dD