| Le Reazioni Inorganiche: Formazione di Sali Ternari da un metallo e un non-Metallo | ||
| Formazione del sale ternario Ipoclorito Aurico (Au(ClO)3) |
Si vogliano scrivere e bilanciare le reazioni necessarie per ottenere un sale ternario, partendo da un metallo e da un non-metallo.
Ammettiamo che il non-metallo sia Cloro ipocloroso (Cl+1) e il metallo sia Oro aurico (Au+3).
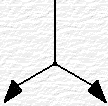
L'esercizio va svolto facendo riferimento allo
schema generale delle reazioni
che conducono alla formazione del sale ternario, partendo da metallo e non metallo;- il metallo dà, per reazione con Ossigeno, l'ossido: nel caso in esame
Ossido Aurico;
- l'ossido Aurico ottenuto vien fatto reagire con acqua, ottenendosi l'Idrossido Aurico;
- analogamente il non metallo dà, per reazione con Ossigeno, l'anidride;
nel caso in esame Anidride Ipoclorosa;- l'Anidride Ipoclorosa ottenuta forma, fatta reagire con acqua, l'Acido Ipocloroso;
- infine il sale, vale a dire il Ipoclorito Aurico si sintetizza per reazione diretta tra idrossido e ossiacido.
Nello schema a lato, qui a destra, è riportato quanto detto.
| Oro | Cloro | |||||
 +O2 +O2 |
 +O2 +O2 |
|||||
| Ossido Aurico | Anidride Ipoclorosa | |||||
 +H2O +H2O |
 +H2O +H2O |
|||||
| Idrossido Aurico | Acido Ipocloroso | |||||
 |
||||||
|
||||||
Pareggiando le valenze tra Cloro ipocloroso (Cl+1) e Ossigeno (O-2) ricaviamo la formula
dell'Anidride Ipoclorosa;
pareggiando le valenze tra Oro (Au+3) e
Ossigeno (O-2) ricaviamo la formula dell' Ossido Aurico;
il pareggiamento si raggiunge a +2 | -2 per l' Anidride Ipoclorosa e a +6 | -6 per l'Ossido Aurico.

| Cl+1 | O-2 |
| Cl+1 | |
| +2 | -2 |
| Au+3 | O-2 |
| O-2 | |
| Au+3 | O-2 |
| +6 | -6 |

| Per l'Anidride IpoClorosa si ottiene allora: Cl2O; mentre per l'ossido Aurico si ha: Au2O3 |
2Cl2 + O2  2 Cl2O
2 Cl2O
4Au + 3O2  2Au2O3
2Au2O3
scriviamo la reazione di ottenimento dell'Acido Ipocloroso:
Cl2O + H2O  2HClO
2HClO
e pareggiamo le valenze tra Au+3 e OH- per ricavarci la formula dell'Idrossido Aurico:
| Au+3 | OH- |
| OH- | |
| OH- | |
| +3 | -3 |
ottenendosi la formula Au(OH)3 mentre la corrispondente reazione, opportunamente bilanciata, è:
Au2O3 + 3H2O  2Au(OH)3
2Au(OH)3
Abbiamo così sia la formula dell'Acido Ipocloroso, sia quella
dell'Idrossido Aurico, e possiamo scrivere la reazione tra i due.
Per potersi ricavare i prodotti di reazione e le loro formule, occorre tener presente come si "dissociano"
l'acido Ipocloroso e l'idrossido Aurico:
il primo, cioè l'acido, libera ioni idrogeno H+ il secondo, cioè l'idrossido, libera ioni ossidrili OH-,
HClO + Au(OH)3 
| |||||||||||||||||||||||||||||||||||
| e così si capisce facilmente che gli ioni idrogeno H+ si legano 1:1 agli ioni ossidrili OH- per formare H2O, cioè Acqua; e il catione Au+3 si lega all'anione IpoClorito ClO- per dare il sale IpoClorito Aurico, pareggiando le valenze: |
| Au+3 | ClO- |
| ClO- | |
| ClO- | |
| +3 | -3 |

| Per l' IpoClorito Aurico Si ottiene allora la formula: Au(ClO)3 |
e per finire, si ha la seguente reazione già opportunamente bilanciata:
3HClO + Au(OH)3  Au(ClO)3 + 3H2O
Au(ClO)3 + 3H2O
|
Supponiamo di mettere a reagire 1,56 g di acido IpoCloroso con una quantità in eccesso di idrossido Aurico; calcolare la quantità in grammi di Ipoclorito Aurico che si forma se l'acido reagisce completamente. Se sappiamo che l'acido messo a reagire ammonta a 1,56 g, ci deve essere un modo per calcolare la quantità di sale che si forma: è ragionevole pensare che le varie quantità reagiscano in modo proporzionale tra loro (ed è quello che afferma la legge empirica delle proporzioni definite e costanti di Proust). Impostando quindi una proporzione è possibile passare dalla quantità di Acido messa a reagire, alla quantità di sale che si forma; una complicazione consiste nel fatto che le quantità devono essere espresse in MOLI e non in grammi. Cosa si utilizza per impostare la proporzione? Si usano i coefficienti stechiometrici di reazione delle sostanze considerate, cioè icoefficienti numerici che compaiono nella reazione bilanciata davanti alle sostanze coinvolte nel calcolo; nel nostro caso le sostanze sono per ipotesi l'Acido IpoCloroso e l'IpoClorito Aurico e i coefficienti, intesi come quantità espresse in moliIn ragione di questo si ha 3 : 1 chiamatoRAPPORTO TEORICO MOLARE DI REAZIONE e questo significa che se si mettessero (ecco perchè TEORICO) a reagire 3 moli di acido, si formerebbe da esse 1 mole di sale. In realtà le moli di acido messe a reagire sono quelle corrispondenti a 1,56 grammi e possono essere calcolate, nota la massa, con la formula: nHClO = mHClO/MMHClO dove MM indica la massa molare, ossia la massa di una mole, che si può determinare dal Peso Molecolare o dal Peso Formula della sostanza considerata, a seconda che quest'ultima sia di natura molecolare o ionica.Nel caso in esame si deve calcolare il Peso Molecolare PM: PMHClO = PAH + PACl + PAO = 1 + 35,5 + 16 = 52,5 cioèMM = 52,5 g/moli dal momento che la massa molare è data dal Peso Molecolare espresso in g/moli.Di conseguenza, sostituendo e facendo i calcoli si trova nHClO = mHClO/MMHClO = 1,56 g /52,5 g/moli = 0,0297 moli In tal modo si sono trasformati i grammi in moli di acido messe a reagire. Queste moli produrrano nAu(ClO)3 moli di sale e quindi si può impostare il RAPPORTO MOLARE ATTUALE DI REAZIONE vale a direnHClO: nAu(ClO)3 La proporzione che consente di ottenere le moli di sale che si formano attualmente (cioè nell'esempio specifico, quindi veramente) si ricava uguagliandoRAPPORTO TEORICO = RAPPORTO ATTUALE vale a dire:3 : 1 = nHClO : nAu(ClO)3 ottenendo dalla proporzione:nAu(ClO)3 = nHClO/3 = 0,0297/3 = 0,00990 moli (di sale) Nell'ultimo passaggio dalle moli di sale si ottengono i grammi di sale con la formula inversamAu(ClO)3 = nAu(ClO)3 · MMAu(ClO)3 l'ultimo problema da risolvere è il calcolo della massa molare del sale, che non è nota.Essa si determina dal Peso Formula del sale (si badi bene che non si può parlare di Peso molecolare per un sale, dal momento che si tratta di una sostanza ionica). Dunque si ha: PFAu(ClO)3 = PAAu + 3 PACl + 3 PAO = 197 + 3 x 35,5 + 3 x 16 = 352 e quindi il dato che si ottiene èMMAu(ClO)3 = 352 g/moli e così, per quanto detto in precedenza, si ha:mAu(ClO)3 = 0,00990 · 352 = 34,8 g |