Tratto da www.pianetachimica.it del prof. Mauro Tonellato
Benzene e aromaticità
Il Benzene C6H6 è una molecola ciclica planare nella quale tutti gli atomi dell’anello sono ibridati sp2 e formano, con il restante orbitale 2p puro, una corona di orbitali π impegnati in un sistema di doppi legami coniugati.
Il benzene, pur avendo tre doppi legami, ha proprietà molto diverse da quelle dei normali alcheni al punto da essere inserito in una classe di composti a sè stante, i composti aromatici.
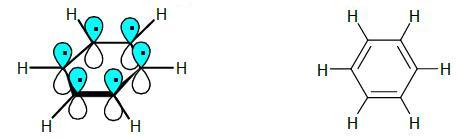
Il Benzene e gli altri composti aromatici hanno le seguenti caratteristiche:
- sono più stabili rispetto alle corrispondenti molecole a catena aperta
- mostrano dei picchi caratteristici all’NMR (Risonanza Magnetica Nucleare)
- la lunghezza dei legami dell’anello è intermedia tra quella di un singolo e di un doppio legame
- danno reazioni di sostituzione elettrofila piuttosto che di addizione elettrofila al doppio legame.
Vediamo uno per uno i vari punti
Gli anelli aromatici sono più stabili
Il Benzene, in reazioni come l’idrogenazione e la combustione, libera meno energia rispetto ad altre molecole non aromatiche.
Se il Benzene fosse semplicemente un trialchene cioè non avesse doppi legami coniugati, come invece sappiamo ha, in tal caso si potrebbe chiamare Esatriene, e dal momento che il Calore di idrogenazione in un polialchene è proporzionale al numero di doppi legami, quello del Benzene dovrebbe essere il triplo di quello del cicloesene cioè
ΔHIdrogenazione = 3 · ΔH (cicloesene) = 3 · (-28,6 kcal/mol) = -85,8 kcal/mol
Invece, nel benzene, questo calore è ΔH = -49,8 kcal/mol, come si vede nel disegno qui sotto, quindi il benzene possiede 36 kcal/mol meno del previsto.
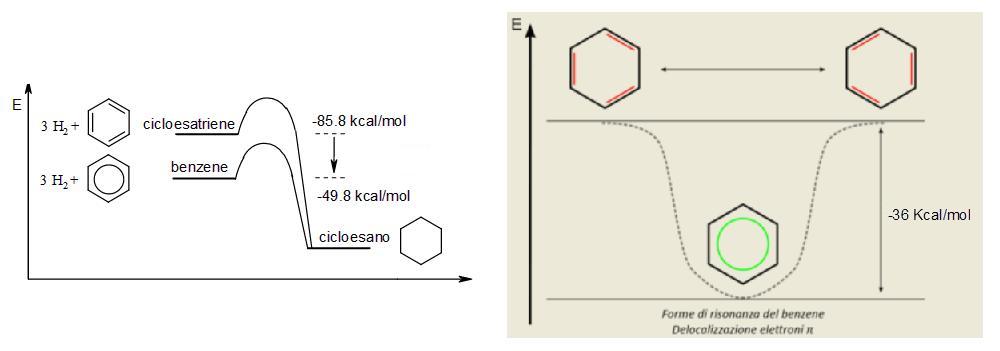
Questa maggiore stabilità di 36 kcal/mol è chiamata
Energia di coniugazione.
La lunghezza dei legami dell’anello è anomala
I sei legami Carbonio-Carbonio del Benzene hanno una lunghezza (1,40 Å) un po’ più corta di quella di un singolo legame (1,53 Å), ma un po’ maggiore di quella di un normale doppio legame (1,33 Å).
Questo indica che hanno un ordine di legame intermedio tra 1 e 2, cioè di circa 1,5.
Tutte e due le principali teorie che descrivono le molecole hanno cercato di spiegare queste strane caratteristiche del benzene.
La teoria VB (legame di valenza) usa gli orbitali ibridi e la risonanza; la teoria MO (Orbitale Molecolare) usa i legami e gli antilegami.
Benzene secondo la teoria VB
La teoria VB descrive il benzene come un ibrido di risonanza che può essere rappresentato dalle due forme limite di risonanza mostrate qui sotto.
La molecola vera non corrisponde a nessuna delle due strutture, ma è una via di mezzo tra queste (ibrido); in ogni caso è più stabile di ciascuna delle due strutture limite.
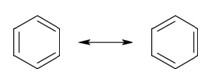 La teoria VB dice inoltre che quando le due forme limite sono stabili e identiche, si può prevedere una ulteriore stabilità dell’ibrido di risonanza,in questo modo si giustificano le 36 kcal/mol dell’energia di
coniugazione osservata nel benzene.
La teoria VB dice inoltre che quando le due forme limite sono stabili e identiche, si può prevedere una ulteriore stabilità dell’ibrido di risonanza,in questo modo si giustificano le 36 kcal/mol dell’energia di
coniugazione osservata nel benzene.
Anche le lunghezze di legame anomale del benzene trovano una semplice spiegazione con la teoria della risonanza.
Basta osservare che ogni legame è rappresentato doppio in una struttura e singolo nell’altra, quindi si può prevedere che i sei legami siano tutti uguali e che abbiano ordine di legame 1,5 .
La teoria VB, quindi, spiega correttamente le proprietà del benzene, ma prevede che siano aromatiche tutte le molecole cicliche con doppi legami coniugati dato che per tutte si possono scrivere forme di risonanza identiche.
In realtà alcune molecole, come il ciclobutadiene e il cicloottatetraene (vedi avanti), che possiedono un numero pari di coppie di elettroni π, non sono aromatiche, però questo non è spiegabile con la teoria VB.
Benzene secondo la teoria MO
La teoria MO dice che gli orbitali molecolari devono essere calcolati con la stessa tecnica usata per gli orbitali atomici, cioè tenendo conto dei campi elettrostatici dei nuclei e di tutti gli elettroni presenti.
Questo approccio, però, è molto complesso dal punto di vista matematico, e quindi si sono dovute introdurre delle semplificazioni.
Una delle più usate è chiamata LCAO, combinazione lineare di orbitali atomici.
Anche così, però, i calcoli restano complessi e richiedono l’aiuto di un computer.
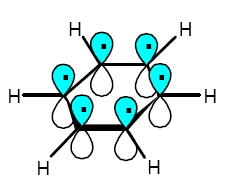
Dato che, negli anelli aromatici, gli orbitali π sono perpendicolari a quelli σ, i due sistemi di orbitali si possono considerare linearmente indipendenti.
Questo consente di calcolare gli orbitali molecolari π applicando la tecnica LCAO ai soli orbitali atomici 2pz del Carbonio.
Il calcolo risulta quindi semplificato.
Se i doppi legami del benzene non fossero coniugati, i sei orbitali atomici 2pπ formerebbero tre coppie di orbitali di legame e antilegame come se appartenessero a tre molecole di etilene, come è mostrato nel grafico qui sotto a sinistra
Nel benzene, invece, i sei orbitali atomici 2pπ si combinano tra loro e formano sei orbitali molecolari π, tre di legame e tre di antilegame, che, per effetto della coniugazione, hanno le energie mostrate nel grafico qui sotto a destra (nel quale è mostrata anche con la regola del poligono).
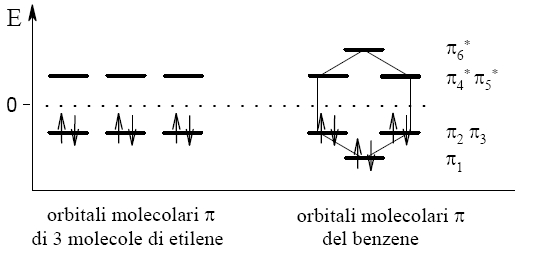
I sei elettroni degli orbitali 2pπ riempiono i tre orbitali π di legame.
L’orbitale di legame π1 ha un’energia più bassa degli altri, questo abbassa l’energia della molecola e permette di giustificare l’energia di coniugazione del benzene di 36 kcal/mol.
I tre orbitali π di legame del benzene sono costituiti da una coppia di orbitali degeneri, cioè di uguale energia, (π2 e π3 ) e da un orbitale di energia più bassa (π1 ).
Questo vale per tutti gli anelli con doppi legami coniugati: vi è sempre un orbitale di bassa energia e poi coppie di orbitali degeneri di energia crescente.
Da qui nasce la regola di Hückel:
un anello è aromatico se possiede 4n+2 elettroni in un sistema ciclico di orbitali π coniugati.
Infatti solo un numero dispari di coppie di elettroni π può riempire perfettamente un numero dispari di orbitali di legame.
Nel 1931 Hückel ha calcolato la forma e l’energia dei sei orbitali molecolari π del benzene in un lavoro pionieristico che è durato mesi.
Oggi, con un programma di modellistica molecolare come ArgusLab, in pochi minuti possiamo ottenere gli stessi risultati.
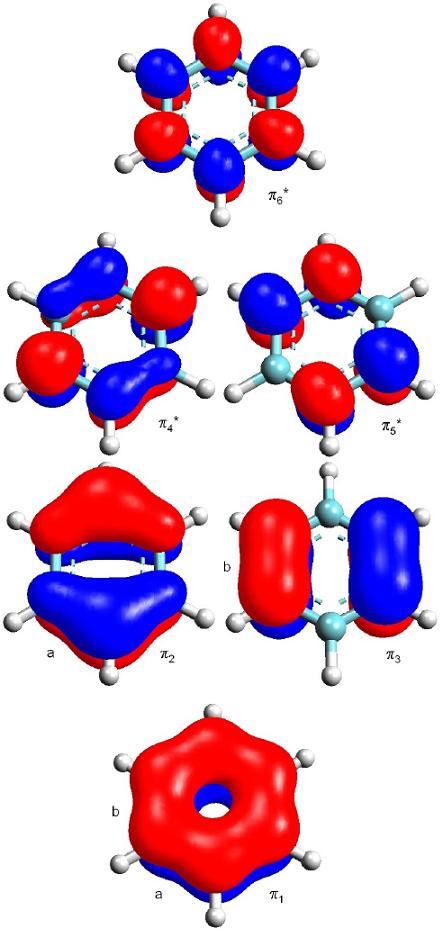
Qui a destra sono riportati, in ordine di stabilità, i sei orbitali molecolari del sistema π del benzene: i tre orbitali di legame sono pieni, mentre i tre di antilegame sono vuoti.
L’orbitale più in basso, π1, è quello più stabile e abbraccia tutti e sei gli atomi di carbonio dell’anello.
Questa trattazione è in contrasto con quanto afferma la teoria VB che attribuisce ai tre orbitali π la stessa energia.
Tuttavia dati sperimentali di spettroscopia fotoelettronica dimostrano, strappando elettroni π dalla molecola del benzene, che questa leggera differenza nelle energie dei legami esiste veramente, come è previsto dalla teoria MO.
Questa trattazione permette di rispondere anche al problema delle lunghezze di legame.
Osservando gli orbitali molecolari π si vede che il legame C-C in basso (indicato con la lettera a) possiede un doppio legame nell’orbitale π1 distribuito tra sei legami e nell’orbitale π2 distribuito tra quattro legami quindi ha 1/6 più 1/4 di carattere di doppio legame, cioè 5/12 π, un po’ meno di mezzo doppio legame.
Il legame C-C di sinistra (indicato con b), invece, possiede un doppio legame nell’orbitale π1 distribuito tra sei legami e nell’orbitale π3 distribuito tra due legami, quindi ha 1/6 più 1/2 di carattere di doppio legame, cioè 4/6 π, un po’ più di mezzo doppio legame.
I sei legami C-C del benzene, secondo la teoria MO quindi, non sono tutti identici: due hanno un po’ più di mezzo doppio legame, gli altri quattro un po’ meno.
Per questioni di simmetria, però, queste situazioni risultano mescolate, infatti i sei carboni sono indistinguibili e non possono giustificare un’orientazione privilegiata degli orbitali.
Si potrebbe anche argomentare che a determinare l’ordine di legame dei sei legami C-C concorra quasi esclusivamente l’orbitale molecolare π1, dal quale risulta senza ombra di dubbio un ordine di legame di 1,5 per tutti e sei gli atomi dell’anello benzenico.
Spettroscopia NMR
L’NMR, cioè la Risonanza Magnetica Nucleare, è la tecnica più efficace per decidere se un anello è aromatico.
Quando gli elettroni π di un alchene sono sottoposti al campo magnetico di uno strumento NMR, si produce una circolazione elettronica che crea un campo magnetico indotto opposto a quello applicato nel centro della molecola, ma che è concorde con il campo applicato sui protoni vinilici come si vede nella figura qui sotto a sinistra.
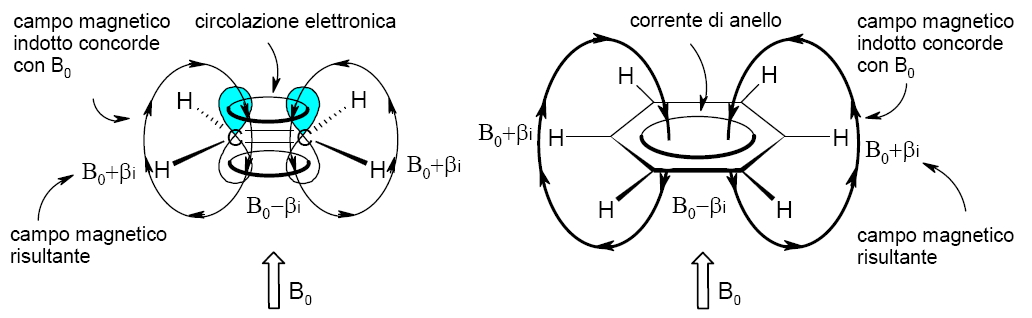
I protoni vinilici sentono un campo magnetico più intenso, perchè l’induzione totale è Bt = B0 + βi , dove B0 è dovuta al campo magnetico applicato dall’esterno, mentre βi è la componente indotta per via della corrente elettronica del doppio legame; e quindi risuonano a frequenze insolitamente alte, tra 5 e 6 ppm .
In un anello aromatico il contributo βi è più grande perchè l’orbitale molecolare π1 produce una corrente di anello molto più intensa di quella di un alchene.
Per questo motivo l’assorbimento dei protoni di un anello aromatico è spostato di altre 2 ppm verso frequenze maggiori rispetto ai protoni vinilici e cade tra 7 e 8 ppm.
L’aromaticità di un anello, quindi, può essere dimostrata dalla presenza di segnali NMR a 7-8 ppm .
Concludendo, le due teorie VB e MO, riescono entrambe a spiegare la particolare stabilità dell’anello benzenico e la sua struttura con sei legami identici.
La teoria VB, però, risulta molto più semplice ed è la più utilizzata a livello didattico perchè non solo interpreta in modo elementare le proprietà del benzene, ma anche permette di scrivere facilmente i meccanismi di reazione che illustrano l’andamento dettagliato delle reazioni.
Cicloottatetraene: una molecola antiaromatica
Se la teoria VB è così semplice e conveniente, perchè si continua a parlare della teoria MO?
Perchè le previsioni della teoria VB sull’aromaticità delle molecole non si sono rivelate sempre esatte!
La teoria VB, infatti, prevede che siano aromatici tutti gli anelli nei quali gli atomi sono coinvolti in un sistema ciclico di doppi legami coniugati perchè si possono sempre scrivere più forme stabili di risonanza.
Questi anelli possono contenere un numero qualsiasi di coppie di elettroni π, quindi 4, 6, 8, 10, 12, 14, 16, ... elettroni.
La teoria MO, invece, prevede che siano aromatici solo gli
anelli che contengono un numero dispari di coppie di elettroni π cioè 4n+2 elettroni.
La teoria MO prevede quindi che gli anelli che contengono 4n elettroni π perdano del tutto i vantaggi della coniugazione e quindi siano antiaromatici, cioè siano meno stabili della corrispondente struttura aperta (che comunque ha doppi legami coniugati).
Queste previsioni della teoria MO si sono rivelate esatte e infatti gli anelli con 4 e 8 elettroni π non si sono dimostrati aromatici perchè liberano, nella reazione di idrogenazione, lo stesso calore di molecole non coniugate e non mostrano all’NMR il caratteristico segnale a 7-8 ppm.
Discutiamo qui il caso del cicloottatetraene, un anello di 8 carboni con quattro doppi legami.
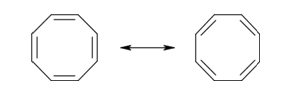 Il cicloottatetraene (8 elettroni π) è giudicato aromatico dalla teoria VB, dato che si possono scrivere due forme limite di risonanza identiche e quindi particolarmente stabilizzate come accade per il
benzene (vedi figura).
Il cicloottatetraene (8 elettroni π) è giudicato aromatico dalla teoria VB, dato che si possono scrivere due forme limite di risonanza identiche e quindi particolarmente stabilizzate come accade per il
benzene (vedi figura).Il cicloottatetraene, invece, è antiaromatico per la teoria MO dato che non obbedisce alla regola di Hückel 4n+2 per la quale sono aromatici gli anelli con 2, 6 o 10 elettroni π, ma non quelli con 8.
Se l’anello del cicloottatetraene fosse planare, gli 8 orbitali atomici 2pπ sarebbero coniugati e darebbero luogo a 8 orbitali molecolari π, 3 di legame, 2 di non legame e 3 di antilegame, come si vede nel grafico qui sotto a sinistra ottenuto con la regola del poligono:
Disegnata una circonferenza, tracciare il diametro orizzontale, che corrisponderà al valore ZERO di Energia di legame, cioè ad una condizione di non-legame;
sistemare coppie di punti simmetricamente distribuiti sulla circonferenza, fino ad un totale di punti uguale al numero di atomi di
carbonio legati nella molecola in esame (6 per il benzene, otto per cicloottatetraene, ecc..., ovviamente compresi i due punti ai poli sud e nord della
circonferenza;) per ogni punto tracciare un tratto breve orizzontale corrispondente ad un orbitale molecolare π.
Si avrà un orbitale al polo sud, eventualmente due degeneri per ogni tropico (capricorno e cancro, continuando con l’analogia geografica), due, se previsti all’equatore (sono orbitali no-bond, quelli all’equatore).
Sistemati gli orbitali, distribuire gli elettroni per ogni orbitale molecolare, cominciando da quello al polo sud, cioè a più bassa energia
Si avrà un orbitale al polo sud, eventualmente due degeneri per ogni tropico (capricorno e cancro, continuando con l’analogia geografica), due, se previsti all’equatore (sono orbitali no-bond, quelli all’equatore).
Sistemati gli orbitali, distribuire gli elettroni per ogni orbitale molecolare, cominciando da quello al polo sud, cioè a più bassa energia
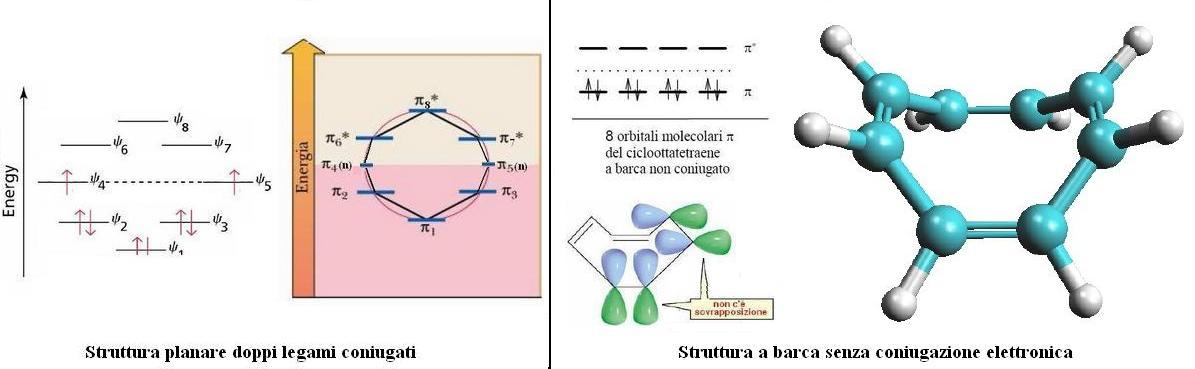
Applicando la regola del Poligono al cicloottatetraene, si ha la situazione a sinistra nella figura qui sopra, con due orbitali molecolari no-bond, avendo otto atomi, otto elettroni π e otto orbitali MO.
Riempiendo questo sistema con 8 elettroni, si mandano 6 elettroni negli orbitali di legame e 2, gli ultimi due, finiscono, spaiati, nei due orbitali di non legame che sono degeneri; quindi il guadagno extra di energia realizzato dalla coppia di elettroni nell’orbitale più stabile π1 e negli orbitali π2 e π3 viene quasi del tutto sprecato dai due elettroni nei due orbitali π4 e π5 di non legame.
In ogni caso non c’è maggior stabilizzazione rispetto alla molecola non planare a doppi legami non coniugati, figura a destra ottenuta con ArgusLab, il cui schema di orbitali molecolari è raffigurato al cnetro nella stessa figura (sono quattro MO leganti che sicuramente danno luogo ad una struttura più stabile).
Quindi, se il cicloottatetraene avesse quattro doppi legami coniugati, non sarebbe più stabile della molecola non coniugata.
Dato che la struttura planare non è vantaggiosa, il cicloottatetraene assume una conformazione a barca in modo da minimizzare la tensione angolare come si vede a destra nella citata figura.
Per il benzene si ha il seguente schema riassuntivo
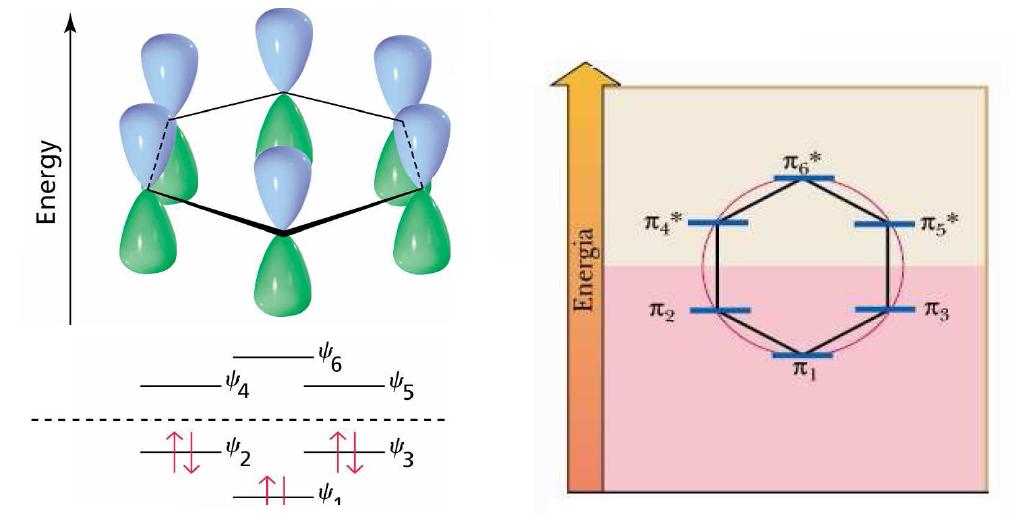
Con a destra lo schema delle energie degli orbitali ottenuto con la Regola di Frost o del Poligono e a sinistra con gli elettroni (6π) negli orbitali leganti.
Gli Annuleni sono molecole monocicliche con sistemi di doppi legami coniugati, quindi sono ciclopolieni coniugati; anche il cicloottatetraene discusso è un annulene, precisamente si tratta del [8]-Annuene, dove il numero indica gli atomi di carbonio.
Queste sostanze possono avere carattere aromatico, antiaromatico o non-aromatico, a seconda del numero di atomi e coppie di elettroni π o a causa di impedimenti sterici che rendano non planare la struttura molecolare.
Così nell’immagine qui sotto
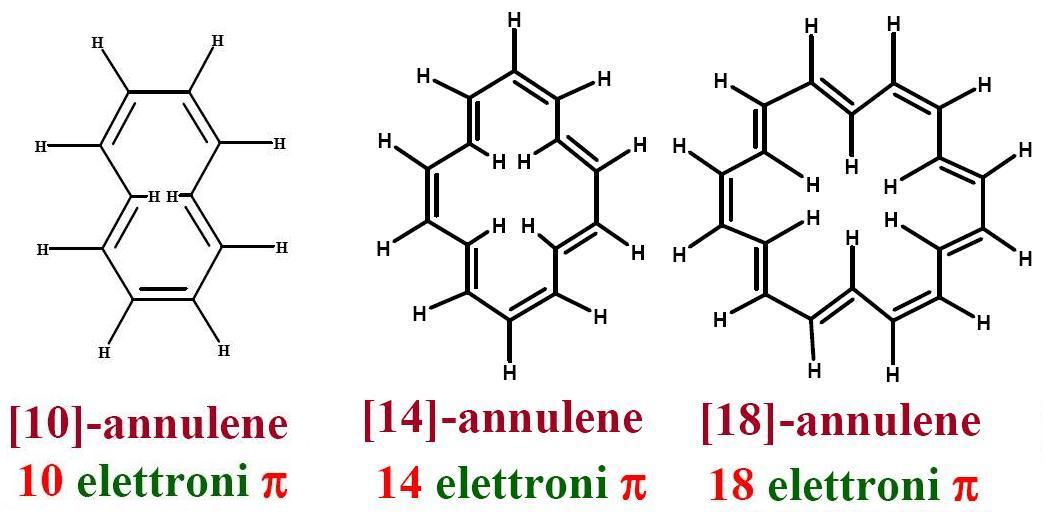
ove sono riportate le strutture di tre annuleni. Vediamo immediatamente che essi rispettano la regola di Hückel avendo un numero dispari di coppie elettroniche; però per i primi due, a 14 e 18 atomi di carbonio o elettroni π, l’aromaticità è confermata dai dati sperimentali, mentre il terzo che dovrebbe essere lo stesso aromatico, in realtà è Non aromatico perchè gli idrogeni interni molto vicini costringono la molecola ad essere non planare per ridurre le tensioni che si sa fanno salire l’energia, distruggendo la coniugazione.
Anche il benzene è un annulene, precisamente [6]-Annulene.
Anello aromatico
Alla luce di quanto visto finora si può dare una nuova definizione di anello aromatico che tenga conto dei risultati della trattazione MO.
Un anello aromatico è: una struttura ciclica planare nella quale tutti gli atomi sono ibridati sp2e i loro orbitali p costituiscono una corona di orbitali π impegnati in un sistema di doppi legami
coniugati.
Per essere aromatico l’anello deve contenere, negli orbitali π, un numero dispari di coppie di elettroni cioè 4n+2 elettroni (2, 6, 10, 14, 18, ...) (regola di Huckel).
Per essere aromatico l’anello deve contenere, negli orbitali π, un numero dispari di coppie di elettroni cioè 4n+2 elettroni (2, 6, 10, 14, 18, ...) (regola di Huckel).
Al contrario, anelli che contengono 4n elettroni π (cioè 4, 8, 12, 16, ...) sono chiamati antiaromatici.
Carbocatione benzilico
Anche la stabilità degli intermedi di reazione può essere discussa utilizzando sia la teoria VB che quella MO.
Qui discuteremo il carbocatione benzilico, uno dei carbocationi più stabili.
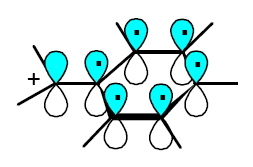 Il carbocatione benzilico ha una struttura planare costituita da sette carboni tutti ibridati sp2.
Il carbocatione benzilico ha una struttura planare costituita da sette carboni tutti ibridati sp2.Anche il CH2 esterno all’anello ha un orbitale 2p che si può sovrapporre con il sistema degli orbitali 2pπ dell’anello (vedi figura qui a lato).
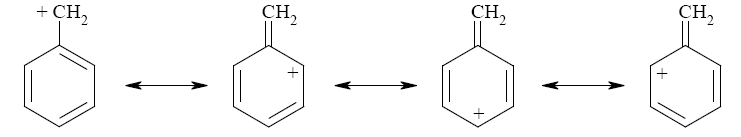
La teoria VB spiega la particolare stabilità del carbocatione benzilico con la risonanza che distribuisce la carica positiva non solo sul CH2 esterno all’anello, ma anche sui tre carboni in posizione orto e para.
La carica positiva del carbocatione è distribuita su 4 atomi di carbonio nella molecola e risulta particolarmente stabilizzata.
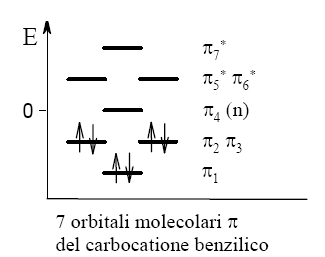 La teoria MO ottiene, per il carbocatione benzilico, un insieme di sette orbitali molecolari π a partire dai sette orbitali atomici 2pπ.
La teoria MO ottiene, per il carbocatione benzilico, un insieme di sette orbitali molecolari π a partire dai sette orbitali atomici 2pπ. Come si vede nel grafico qui a destra, l’orbitale LUMO, cioè l’orbitale vuoto di minore energia, è l’orbitale di non legame π4.
Questo rappresenta l’orbitale vuoto nel quale giungono gli attacchi nucleofili alla molecola.
Possiamo immaginare, quindi, che in questo orbitale sia ospitata la carica positiva del carbocatione benzilico, e, osservandone la struttura, possiamo spiegare la reattività del carbocatione.
Come si può vedere nella figura di sinistra qui sotto, l’orbitale LUMO π4 è dislocato su quattro carboni: il carbonio benzilico e i tre carboni nelle posizioni orto e para dell’anello, gli stessi carboni individuati anche dall’analisi fatta con la teoria VB.
L’orbitale ha un lobo un po’ più grosso in corrispondenza del carbonio benzilico.
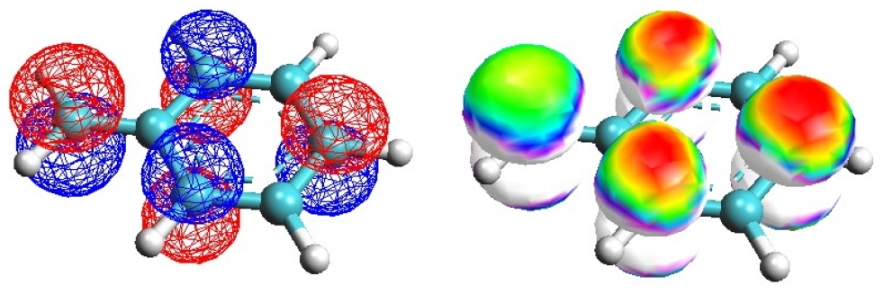
Nell’immagine di destra l’orbitale LUMO è mappato con una scala di colori (rosso, arancione, giallo, verde, ciano, blu, magenta, bianco) per indicare una carica elettrostatica della molecola cha va da +0,2 a +0,4. Il punto più positivo, e quindi più reattivo, è il lobo del carbonio benzilico, il CH2 esterno all’anello, che sulla superficie è colorato in giallo, mentre gli altri lobi sono rossi.
Si noti che gli orbitali molecolari π ottenuti con la trattazione MO permettono di spiegare oltre alla stabilità del carbocatione benzilico, anche la stabilità del radicale e del carbanione benzilico.
Infatti la stabilità che si è osservata nel carbocatione, dovuta ai sei elettroni negli orbitali di legame π1, π2, π3, non viene compromessa dall’ingresso di altri elettroni.
Questi non vanno in orbitali di antilegame, come accade in altre molecole, ma sono ospitati nell’orbitale di non legame π4 che quindi può essere vuoto (carbocatione) può ospitare un solo elettrone (radicale) o può ospitare due elettroni (carbanione).
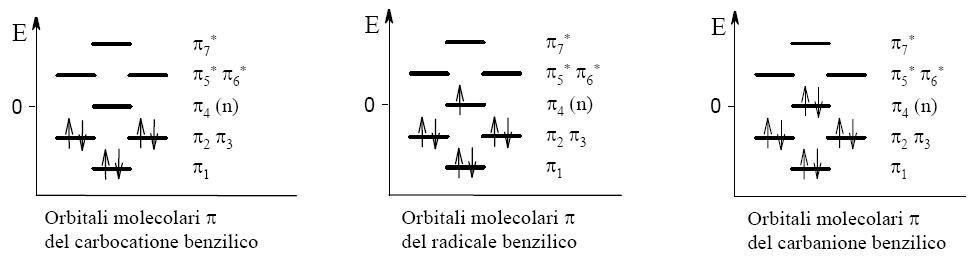
Alle stesse conclusioni arriva anche la teoria VB.
Ancora una volta la teoria VB si fa preferire per la sua semplicità, mentre la teoria MO si fa preferire per il rigore con cui deriva le sue conclusioni dalla risoluzione delle equazioni fondamentali che descrivono la molecola.
Inoltre è da apprezzare la capacità della teoria MO, attraverso le immagini al computer, di farci comprendere le proprieàà della molecola in modo intuitivo quasi come se potessimo vedere la molecola vera.