Ammettiamo che il non-metallo sia Fosforo fosforico (P+5) e il metallo sia Ferro ferroso (Fe+3).
|
L'esercizio va svolto facendo riferimento allo schema generale delle reazioni che conducono alla formazione del sale ternario, partendo da metallo e non metallo;
Nello schema a lato, qui a destra, è riportato quanto detto. |
| Ferro | Fosforo | |||||
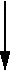 +O2 +O2 |
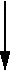 +O2 +O2 |
|||||
| Ossido Ferroso |
Anidride Fosforica |
|||||
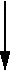 +H2O +H2O |
 +H2O +H2O |
|||||
| Idrossido Ferroso |
Acido Fosforico |
|||||
 |
||||||
|
||||||
|
Pareggiando le valenze tra Fosforo (P+5) e Ossigeno (O-2) ricaviamo la formula
dell'Anidride fosforica; |
 |
|
|

Per l'Anidride fosforica si ottiene allora: P2O5; mentre per l'Ossido ferroso si ha: FeO |
P4 + 5O2  2 P2O5
2 P2O5
2Fe + O2  2FeO
2FeO
| ||
scegliamo di scrivere la reazione di ottenimento dell'Acido Fosforico: |
P2O5 + 3H2O |
| Fe+2 | OH- |
| +2 | -2 |
Fe(OH)2
mentre la corrispondente reazione, opportunamente bilanciata, è:FeO + H2O  Fe(OH)2
Fe(OH)2
NOTA BENE: se vuoi svolgere l'esercizio con l'acido pirofosforico clicca sul pulsante qui accanto
|
A questo punto abbiamo sia la formula dell'Acido Fosforico, sia quella
dell'Idrossido ferroso, e possiamo scrivere la reazione tra i due.
Per potersi ricavare i prodotti di reazione e le loro formule, occorre tener presente come si "dissociano"
l'Acido Fosforico e l'Idrossido Ferroso: il primo, cioè l'acido, libera ioni idrogeno
H+ l'idrossido, libera ioni ossidrili OH-,
e così si capisce facilmente che gli ioni idrogeno H+ si legano 1:1 agli ioni ossidrili OH- per formare H2O, cioè Acqua; e il catione Fe+2 si lega all'anione Fosfato PO4-3 per dare il sale Fosfato ferroso, pareggiando le valenze:
In definitiva si ottiene la seguente reazione opportunamente bilanciata: 2 H3PO4 + 3Fe(OH)2 | |||||||||||||||||||||||||||||||||||||||||||||||||
|
coefficienti stechiometrici di reazione delle sostanze considerate, cioè icoefficienti numerici che compaiono nella reazione bilanciata davanti alle sostanze coinvolte nel calcolo; nel nostro caso le sostanze sono per ipotesi l'Acido Fosforico e Fosfato Ferroso e i coefficienti, intesi come quantità espresse in moli, sono 2 per l'acido e 1, sottinteso, per il Fosfato.
2 : 1 chiamatoRAPPORTO TEORICO MOLARE DI REAZIONE e questo significa che se si mettessero (ecco perchè TEORICO) a reagire 2 moli di acido, si formerebbe da esse 1 mole di sale. In realtà le moli di acido messe a reagire sono quelle corrispondenti a mH3PO4 = 4,15 grammi e possono essere calcolate, sapendo la massa, con la formula: nH3PO4 = mH3PO4/MMH3PO4 Dove MM indica la massa molare, ossia la massa di una mole, che si può determinare dal Peso Molecolare
o dal Peso Formula della sostanza considerata, a seconda che quest'ultima sia di natura molecolare o ionica.
PMH3PO4 = 3•PAH + PAP+4•PAO = 3•1+31+4•16 = 98 nH3PO4 = mH3PO4/MMH3PO4 = 4,15 g/98g/moli = 0,0423 moli In tal modo si sono trasformati i grammi in moli di acido messe a reagire. Queste moli produrrano nFe3(PO4)2 moli di sale e quindi si può impostare il RAPPORTO MOLARE ATTUALE DI REAZIONE vale a direnH3PO4: nFe3(PO4)2 La proporzione che consente di ottenere le moli di sale che si formano attualmente (cioè nell'esempio specifico, quindi veramente) si ricava uguagliandoRAPPORTO TEORICO = RAPPORTO ATTUALE vale a dire:2 : 1 = nH3PO4 : nFe3(PO4)2 ottenendo dalla proporzione:nFe3(PO4)2 = nH3PO4/2 = 0,0423/2 = 0,0212 moli (di sale) Nell'ultimo passaggio dalle moli di sale si ottengono i grammi di sale con la formula inversamFe3(PO4)2 = nFe3(PO4)2·MMFe3(PO4)2 l'ultimo problema da risolvere è il calcolo della massa molare del sale, che non è nota.Essa si determina dal Peso Formula del sale (si badi bene che non si può parlare di Peso molecolare per un sale, dal momento che si tratta di una sostanza ionica). Dunque si ha: PFFe3(PO4)2 = 3•PAFe + 2•PAP + 8•PAO = 3•55,8 + 2•31 +8•16 = 357,4 e quindi il dato che ci serve èMMFe3(PO4)2 = 357,4 g/moli e così, per quanto detto in precedenza, si ha:mFe3(PO4)2 = 0,0212 · 357,4 = 7,58 g |