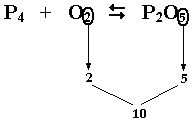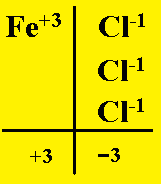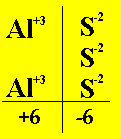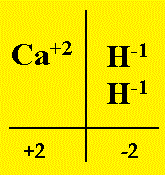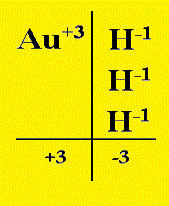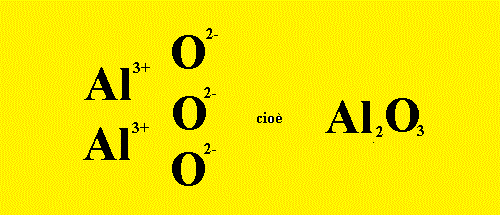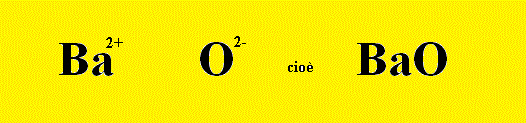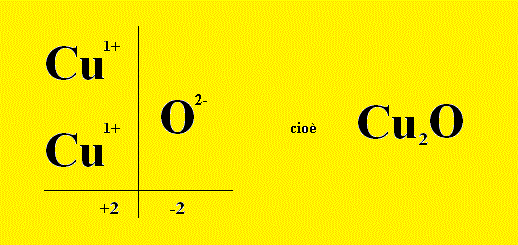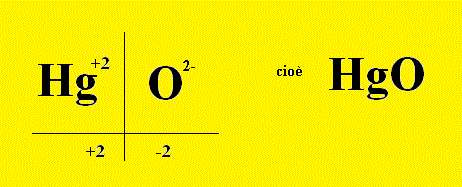Le Reazioni Chimiche
In Chimica le Trasformazioni Chimiche hanno un’importanza fondamentale e quindi è d’obbligo il loro studio.
Una Reazione Chimica comporta sempre un cambiamento della natura delle sostanze di partenza che si trasformano sempre in altre, completamente diverse.
 In una reazione chimica c’è sempre una situazione iniziale (sostanze reagenti o Reagenti) e una situazione finale (Prodotti): alla fine della reazione i Reagenti si sono trasformati in tutto o in parte nei Prodotti.
Quanto detto, può essere rappresentato schematicamente così:
In una reazione chimica c’è sempre una situazione iniziale (sostanze reagenti o Reagenti) e una situazione finale (Prodotti): alla fine della reazione i Reagenti si sono trasformati in tutto o in parte nei Prodotti.
Quanto detto, può essere rappresentato schematicamente così:
Reagenti ===> Prodotti
Tutte le reazioni possono essere ricondotte a questo schema fondamentale. Naturalmente per rappresentare Reagenti e prodotti si usano le loro Formule chimiche. Facciamo un primo esempio, considerando la formazione dell’acqua, la cui formula chimica è H2O; la reazione a parole si scrive:
Idrogeno + Ossigeno ===> Acqua
Dal linguaggio naturale umano bisogna passare al linguaggio della chimica che si avvale di Simboli chimici e di formule chimiche per indicare Reagenti e Prodotti.
A questo proposito, dal momento che Ossigeno e Idrogeno sono Elementi chimici appartenenti alla categoria dei Non Metalli, hanno formula chimica NON Coincidente con il Simbolo; quindi mentre i simboli sono rispettivamente O e H, le formule sono invece, come già visto, O2 e H2.
Passando quindi alle formule chimiche, ricordando che quella dell’acqua è H2O, si ha:
H2 + O2 ===> H2O
La reazione è scritta correttamente perché sono riportate le formule esatte di tutte le sostanze chimiche coinvolte; però non è bilanciata.
Che cosa significa che non è bilanciata?
|
Bilanciare una reazione significa fare in modo che essa rispetti la Legge di Conservazione della Massa di Lavoisier secondo questa legge, infatti
|

Attrezzatura usata da Lavoisier per lo studio della reazione
2Hg + O2 ==> 2HgO
Questo significa che tutti gli Elementi chimici presenti nei reagenti si ritrovano in quantità invariata nei prodotti; quindi la massa si conserva in totale e per ogni elemento chimico. Tornando alla reazione di formazione dell’acqua, cosa c’è scritto esattamente? Davanti alle formule di Ossigeno, Idrogeno e Acqua c’è scritto, anche se sottinteso, 1 (uno) perché la formula si riferisce ad una sola molecola… è come se ci fosse scritto:
1 · H2 + 1 · O2 ==> 1 · H2 O
C’è un 1 che moltiplica e quindi è indicato, per il momento, che stiamo facendo reagire una molecola di Ossigeno, una molecola di Idrogeno, per ottenere una molecola di Acqua. Tutto ciò soddisfa la Legge di Lavoisier sulla Conservazione della Massa? Evidentemente no… basta osservare che nei Reagenti ci sono 2 atomi di Idrogeno (sotto forma di molecola H2) e lo stesso dicasi per l’Ossigeno (sotto forma di molecola O2); mentre nei prodotti, sotto forma di molecola d’acqua H2O, ci sono 2 atomi di Idrogeno, ma solo 1 atomo di Ossigeno. Questo equivale a dire, lasciata così la reazione, che passando dai Reagenti ai Prodotti, scompare un atomo di Ossigeno; cioè la massa di ossigeno… si dimezza! Per fare in modo che la reazione verifichi la Legge di Lavoisier, occorre procedere al suo Bilanciamento
| Bilanciare una reazione significaMoltiplicare le formule di reagenti e prodotti per degli opportuniCoefficienti numerici in maniera tale cherisulti verificata la Legge di Lavoisier |
In questo caso basta osservare che, dal momento che nella formula dell’acqua c’è un solo ossigeno, bisogna moltiplicare per 2, così gli atomi di Ossigeno diventano due perché raddoppiano le molecole di acqua.
| 1 · H2 + 1 · O2 ---> 2 · H2O |
Così gli atomi di Ossigeno sono in numero uguale nei Reagenti e nei Prodotti e pari a 2. Però la reazione è sbilanciata, ora, rispetto agli atomi di Idrogeno perché nei Prodotti essi sono 4 (2x2), mentre nei Reagenti sono solo 2. Occorre allora moltiplicare la molecola di Idrogeno nei Reagenti per 2:
2 H2 + O2 <===> 2H2O
Così gli atomi di Idrogeno diventano 4 sia all’inizio che alla fine della reazione che risulta quindi bilanciata.
Questo modo di procedere, per bilanciare una reazione chimica, è generale; si procede per bilanciamenti successivi, fino a quando tutta la reazione risulta essere bilanciata.
Ricapitolando abbiamo allora che per scrivere una reazione completa si procede nel modo seguente:
1) si scrive la reazione a parole 2) si scrive la reazione con le formule chimiche 3) si bilancia la reazione. |
| Vediamo un altro esempio, considerando la reazione tra azoto (N2) e idrogeno (H2) per ottenere ammoniaca (NH3): 1) primo passo: scrivere la reazione a parole: azoto + idrogeno <===> ammoniaca 2) secondo passo:scrivere la reazione in formule: N2 + H2 <===> NH3 3) terzo passo:bilanciare la reazione, se non è bilanciata: facile vedere che neanche questa lo è; osserviamo che gli idrogeni sono 2 (H2) nei reagenti e 3 nei prodotti; 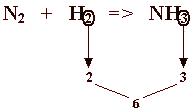 2 e 3 fanno pensare al loro m.c.m. (minimo comune multiplo) che è 6: una ragionevole conclusione è che gli atomi di idrogeno diventino 6 nei reagenti e anche 6 nei prodotti; per ottenere questo occorre moltiplicare x3 l’idrogeno nei reagenti e x2 l’ammoniaca (NH3, così da ottenere 2x3 = 6 H) nei prodotti. In tal modo si ha: N2 + 3H2 <===> 2NH3 ed è facile vedere che la reazione è tutta bilanciata. |
| Consideriamo ancora un esempio: la reazione tra fosforo (P4) e ossigeno (O2) per ottenere anidride fosforica (P2O5) 1) primo passo: scrivere la reazione a parole: fosforo + ossigeno <===> anidride fosforica 2) secondo passo: scrivere la reazione in formule:P4 + O2 <===> P2O5 3) terzo passo: bilanciare, se non è bilanciata:facile vedere che neanche questa lo è; osserviamo che gli ossigeni sono 2 (O2) nei reagenti e 5 nei prodotti; P4 + 5O2 <===> 2P2O5 Risultando così bilanciato anche il fosforo. |
Cominciamo allora a studiare le reazioni che portano alla formazione di composti, partendo dai singoli elementi chimici. Queste reazioni si chiamano REAZIONI DI SINTESI:
| Una Reazione di Sintesi è una reazione che consente di ottenere un composto partendo dai singoli elementi che lo costituiscono. |
Ci occupiamo anzitutto delle Reazioni di Sintesi che conducono alla formazione di Composti Binari, cioè composti costituiti da solo DUE elementi chimici. A questo punto però occorre definire ed approfondire un concetto molto importante per poter scrivere correttamente ed agevolmente le formule chimiche dei composti binari; il concetto di
| VALENZA CHIMICA |
Cos’è la Valenza chimica di un elemento?
In generale possiamo dire che gli elementi si combinano tra di loro in rapporti espressi da numeri interi e piccoli (Teoria Atomica di Dalton) quindi la valenza chimica di un elemento è un valore numerico da attribuire ad ogni elemento che renda conto correttamente di questi rapporti di combinazione.
| Originariamente la Valenza chimica era espressa, per ogni elemento, da un numero romano senza segno (I, II, III, IV, ecc.) il cui significato era ovviamente che se ad un elemento competeva una valenza maggiore questo stava a significare che, al momento di combinarsi con un elemento di valenza minore, doveva impegnare meno atomi di quanti ne dovesse impegnare quello a valenza minore, proprio perché i suoi “valevano ognuno di più”. Noi adotteremo una convenzione leggermente diversa, nel senso che attribuiremo ad ogni elemento un valore positivo o negativo di valenza chimica che al momento di combinarsi si dovranno annullare o pareggiare per somma di atomi di valenza opposta. |
Così se sappiamo che l’alluminio ha valenza +3 (questo si indica con il simbolo Al+3), mentre il cloro ha valenza -1 (Cl-1), al momento di stabilire e ricavarci la formula del Cloruro di Alluminio, lo potremo fare pareggiando le valenze positive di alluminio con quelle negative di cloro, prendendo un numero adeguato di atomi dell’uno e dell’altro, vale a dire:
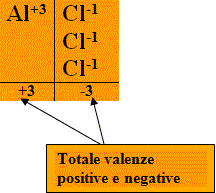
Una volta pareggiate le valenze, si contano gli atomi che sono stati necessari e si mettono insieme a costituire la formula del composto (in questo caso è stato utilizzato 1 atomo di Alluminio e 3 atomi di Cloro, ottenendo quindi AlCl3).
Si può compilare una tabella delle valenze, tenendo presente che i Metalli hanno sempre Valenza positiva (+);i non-Metalli invece hanno valenza negativa quando reagiscono con i Metalli, mentre possono avere sia Valenza positiva o negativa quando reagiscono tra loro (i non-Metalli), con il criterio che quello con più spiccate caratteristiche non metalliche ha valenza negativa, obbligando l’altro non-Metallo ad assumere valenza positiva.
Abbiamo quindi la seguente Tabella di Valenze dei Metalli:
| Fe+3 | Ferro Ferrico | Li+1 | Litio |
| Fe+2 | Ferro Ferroso | Cs+1 | Cesio |
| Na+1 | Sodio | Mg+2 | Magnesio |
| K+1 | Potassio | Al+3 | Alluminio |
| Cu+2 | Rame Rameico | Ba+2 | Bario |
| Cu+1 | Rame Rameoso | Ni+2 | Nichel | Hg+2 | Mercurio Mercurico | Cd+2 | Cadmio |
| Hg+1 | Mercurio Mercuroso | Pb+2 | Piombo |
| Au+3 | Oro Aurico | Sn+2 | Stagno Stagnoso |
| Au+1 | Oro Auroso | Sn+4 | Stagno Tannico |
| Ag+1 | Argento | Pt+2 | Platino |
A proposito della Valenza chimica di alcuni metalli, occorre osservare che sono possibili 2 valori diversi di valenza chimica; il caso più conosciuto è quello del Ferro, ma si hanno anche altri casi, come per esempio per il Rame Cu, il Mercurio Hg, l’Oro Au, lo Stagno Sn.
Nel caso del Ferro abbiamo che esso può assumere valenza +2 e +3 (Fe+2/Fe+3) ed è facile rendersi conto che sorge un problema di nomenclatura perché occorre distinguere tra i due tipi di Ferro. Allora vale la regola che per il metallo con valenza minore (Fe+2) si usa la desinenza –oso e quindi per Fe+2 si parla di Ferro Ferroso, mentre per il Ferro a valenza maggiore (Fe+3) si parla di Ferro Ferrico.
La tabella precedente rende conto dei diversi possibili casi di metalli con valenza doppia.
COMPOSTI BINARI
I metalli, con la relativa valenza, possono dare luogo ai composti binari, definibili in base al seguente schema di classificazione:
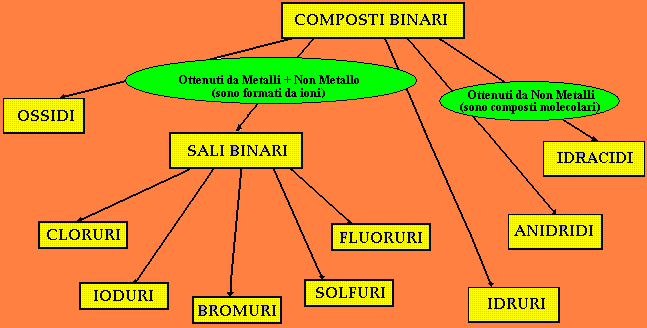
Combinandosi naturalmente con non metalli per i quali si ha la seguente tabella di Valenze:
|
Tabella dei non Metalli di uso frequente e relativa valenza (nei Composti binari) | |||
| Cl- | Cloruro | F- | Fluoruro |
| Br- | Bromuro | I- | Ioduro |
| S-2 | Solfuro | H-1 | Idruro salino |
| O-2 | Ossido | O-2 | Anidride |
| H+1 | Idracidi | ||
Allora risulta che un
Non Metallo (Cl2, Br2, I2, F2, S8)
grazie alla sua
Valenza chimica (Cl-, Br-, I-, F-, S-2)
può legarsi all’Idrogeno (H2) per formare il corrispondente
Idracido (un Acido Binario)
Composti Binari: GLI IDRACIDI
| Gli idracidi sono composti molecolari ottenuti facendo reagire alcuni nonMetalli con idrogeno; sono definiti anche acidi binari |
| I non metalli che danno idracidi sono pochissimi, in particolare considereremo Cl2 , F2 , I2 , Br2 , S8 |
Questi non metalli assumono tutti valenza -1, tranne lo zolfo che assume valenza -2. L’idrogeno che reagisce con loro assume invece valenza +1.
Si ha dunque
Acido Cloridrico (H2 + Cl2 ---> 2HCl)
Acido Bromidrico (H2 + Br2 ---> 2HBr)
Acido Iodidrico (H2 + I2 ---> 2HI)
Acido Fluoridrico (H2 + F2 ---> 2HF)
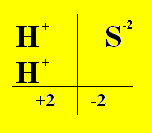
Acido Solfidrico (8H2 + S8 ---> 8H2S)
Infatti facendo ad esempio lo schema di pareggiamento delle valenze per l’acido solfidrico, risulta:
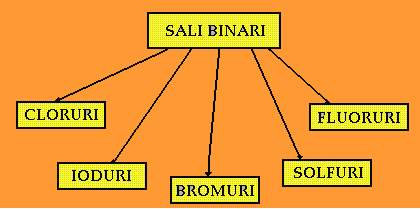
Composti Binari: I SALI BINARI
In maniera analoga risulta che un
Metallo
grazie alla sua
Valenza chimica
può legarsi a Cl2 , Br2 , I2, F2 , S8 per formare
Sali binari
denominati rispettivamente
Cloruri (se il metallo si lega al Cloro, che dà lo ione Cl-)
Bromuri (se il metallo si lega al Bromo, che dà lo ione Br-)
Ioduri (se il metallo si lega allo Iodio, che dà lo ione I-)
Fluoruri (se il metallo si lega al Fluoro, che dà lo ione F-)
Solfuri (se il metallo si lega allo Zolfo, che dà lo ione S-2)
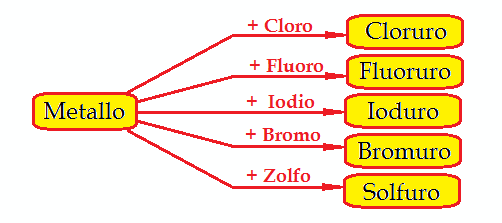
Quindi un Sale Binario si può formare per Reazione diretta tra
Metallo + Non Metallo (Cl2 , Br2 , I2 , F2 , S8)
Si ha dunque il seguente schema:
Questo non è l’unico modo in cui i Sali binari si possono formare, cioè mediante la reazione diretta tra metallo e non metallo.
Un sale binario si può formare anche facendo reagire
Metallo + Idracido (HCl, HBr, HI, HF, H2S)
Quindi si può anche avere il seguente schema:
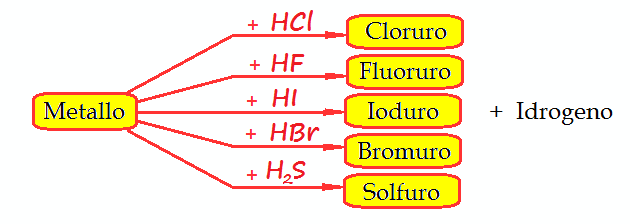
E’ facile capire che sono possibili parecchie combinazioni, con formazione di altrettanti sali binari diversi, dal momento che i metalli sono più di 70 in natura.
Vediamo alcuni esempi di formazione di Sali binari.
|
Supponiamo a questo proposito di fare reagire Ferro e Cloro, ed ammettiamo che il ferro reagisca con la valenza +3, la maggiore (si tratta quindi del Ferro Ferrino) si ha allora la reazione
Ferro + Cloro ---> Cloruro Ferrico Si passa alle formule chimiche:Fe + Cl2 ---> E però occorre ricavarsi la formula del cloruro pareggiando le valenze tra Ferro Ferrico e Cloro: FeCl3 Ottenendo quindi la reazioneFe + Cl2 ---> FeCl3 Che bilanciata, diventa2Fe + 3Cl2 ---> 2FeCl3 |
| Secondo esempio. Supponiamo di far reagire Alluminio e Zolfo; si ha allora la reazione Alluminio + Zolfo ---> Solfuro di Alluminio Si passa alle formule chimiche:Al + S8 ---> Con l’avvertenza che l’alluminio ha valenza +3 e lo zolfo nei solfuri ha valenza -2; pertanto si ha: Al2S3 (solfuro di Alluminio) E quindi la reazione bilanciata:16Al + 3S8 ---> 8Al2S3 |
Composti Binari: GLI IDRURI
I metalli possono reagire anche con Idrogeno H2 per dare un gruppo di composti binari denominati IDRURI SALINI o semplicemente IDRURI: il metallo partecipa con Valenza positiva (ovviamente variabile da metallo a metallo) mentre l’Idrogeno si lega con Valenza -1. Procediamo con ordine scrivendo prima la reazione a parole, poi con le formule chimiche ed infine bilanciandola.| Supponiamo allora nel primo esempio di fare reagire Calcio e Idrogeno; si ha:
Calcio + Idrogeno ---> Idruro di Calcio Ca + H2 ---> Ricavare allora la formula dell’idruro di calcio, pareggiando le valenze: Ca + H2 ---> CaH2 |
| Come secondo esempio si faccia reagire Oro Aurico (Au+3) e Idrogeno; si ha:
Oro + Idrogeno ---> Idruro Aurico Au + H2 ---> Ricavare allora la formula dell’idruro aurico, pareggiando le valenze:
ottenendo infine: 2Au + 3H2 ---> 2AuH3 |
Composti Binari: GLI OSSIDI
Tutti i metalli, reagendo con l’ossigeno, formano ossidi.Fondamentale per scrivere la formula corretta di un ossido è la conoscenza della valenza del metallo che lo forma; se un metallo ha due stati di valenza diversi, si usano per distingure le desinenze
-oso per la valenza minore
-ico per la valenza maggiore
più comuni metalli con valenza doppia (quindi -oso/-ico) sono riportati nella tabella qui sotto:
| Tabella dei Cationi di uso frequente aventi valenza doppia | Fe2+/Fe3+ | Ferro ferroso/Ferro ferrico | Au+/Au3+ | Oro auroso/Oro aurico |
| Hg+/Hg2+ | Mercurio mercuroso/Mercurio mercurico | Cu+/Cu2+ | Rame rameoso/Rame rameico |
| Sn2+/Sn4+ | Stagno stannoso/stagno stannico | ||
La maggior parte dei cationi metallici ha una sola valenza; quelli di uso più comune sono riportati nella seguente tabella:
|
Tabella dei Cationi monovalenti di uso frequente |
|
Na+ (Sodio), K+ (Potassio), Li+ (Litio), Cs+ (Cesio), Rb+ (Rubidio), Ag+ (Argento) |
|
Tabella dei Cationi bivalenti di uso frequente |
Ca+2 (Calcio), Mg+2 (Magnesio), Be+2 (Berillio), Ba+2 (Bario), Sr+2 (Stronzio), Ni+2 (Nichel) Zn+2 (Zinco), Cd+2 (Cadmio), Pt+2 (Platino) |
L’alluminio è Al3+ (trivalente)
I Metalli, reagendo con O2, danno gli Ossidi Basici o semplicemente Ossidi. Dunque:
Gli OSSIDI sono composti binari di tipo ionico che si ottengono facendo reagire un metallo con ossigeno.
|
Primo Esempio: Reazione scritta a parole: (primo passo) Alluminio + Ossigeno ---> Ossido di Allumino Reazione scritta con le formule chimiche: (secondo passo) Scriviamo prima i reagenti, che sono Alluminio e Ossigeno
Al + O2 ---> Gli ioni che formano l’ossido sono sempre un catione metallico (in questo caso il catione trivalente Al+3) e come anione l'ossigeno con due cariche negative: ______________________________________________________________ La reazione allora si scrive: Al + O2 ---> Al2O3 Ma non è bilanciata. Il Bilanciamento della Reazione porta alla forma bilanciata: 4 Al + 3 O2 ---> 2 Al2O3 (terzo passo) |
|
Secondo Esempio: Reazione scritta a parole: (primo passo) Bario + Ossigeno ---> Ossido di Bario Reazione scritta con le formule chimiche: (secondo passo) Scriviamo prima i reagenti, che sono Bario e Ossigeno Ba + O2 ---> Ricaviamoci la formula del prodotto, cioè dell’ossido di Ba, pareggiando le valenze tra Ba2+ e O2- ______________________________________________________________ Gli ioni che formano l’ossido sono sempre un catione metallico (in questo caso il catione bivalente Ba2+) e come anione l'ossigeno con due cariche negative: e quindi si vede che per ogni catione serve, per bilanciare le cariche, un solo anione ossigeno. ______________________________________________________________ La reazione allora si scrive: Ba + O2 ---> BaO Ma non è bilanciata; il Bilanciamento della Reazione porta alla forma bilanciata: 2 Ba + O2 ---> 2 BaO (terzo passo) |
|
Terzo Esempio: Reazione scritta a parole: (primo passo) Rame + Ossigeno ---> Ossido Rameoso Reazione scritta con le formule chimiche: (secondo passo) Scriviamo prima i reagenti, che sono Rame e Ossigeno Cu + O2 ---> Ricaviamoci la formula del prodotto, cioè dell’ossido rameoso, pareggiando le valenze tra Cu1+ e O2- ______________________________________________________________ Gli ioni che formano l’ossido sono sempre un catione metallico (in questo caso il catione monovalente Cu1+) e come anione l'ossigeno con due cariche negative: e quindi si vede che per ogni catione serve, per bilanciare le cariche, un solo anione ossigeno. ______________________________________________________________ La reazione allora si scrive: Cu + O2 ---> Cu2O Ma non è bilanciata; il Bilanciamento della Reazione porta alla forma bilanciata: 4 Cu + O2 ---> 2 Cu2O (terzo passo) |
|
Quarto Esempio: Reazione scritta a parole: (primo passo) Mercurio + Ossigeno ---> Ossido Mercurico Reazione scritta con le formule chimiche: (secondo passo) Scriviamo prima i reagenti, che sono Mercurio e Ossigeno Hg + O2 ---> Ricaviamoci la formula del prodotto, cioè dell’ossido rameoso, pareggiando le valenze tra Hg2+ e O2- ______________________________________________________________ Gli ioni che formano l’ossido sono sempre un catione metallico (in questo caso il catione monovalente Hg2+) e come anione l'ossigeno con due cariche negative: e quindi si vede che per ogni catione serve, per bilanciare le cariche, un solo anione ossigeno. ______________________________________________________________ La reazione allora si scrive: Hg + O2 ---> HgO Ma non è bilanciata; il Bilanciamento della Reazione porta alla forma bilanciata: 2 Hg + O2 ---> 2 HgO (terzo passo) |
Possiamo dunque dire che per
RICAVARE la FORMULA DELL’OSSIDO, pareggiando le valenze dei CATIONI METALLICI (quindi IONI positivi),
occorre come CONTROIONE (ione di segno opposto, negativo) L’OSSIGENO con due valenze negative: O2-
Si ha il seguente prospetto di formule di ossidi:
| Al2O3 Ossido di Alluminio | FeO Ossido Ferroso |
| Na2O Ossido di Sodio | Fe2O3 Ossido Ferrico |
| K2O Ossido di Potassio | Cu2O Ossido Rameoso |
| Au2O3 Ossido Aurico | Au2O Ossido Auroso |
| Li2O Ossido di Litio | CuO Ossido Rameico |
| Rb2O Ossido di Rubidio | Hg2O Ossido Mercuroso | CaO Ossido di Calcio | HgO Ossido Mercurico | BaO Ossido di Bario | MnO Ossido di Manganese | MgO Ossido di Magnesio | ZnO Ossido di Zinco |
Realizzato a cura di Francesco Serra (classe 2A ITIS Ferracciu di Tempio Pausania) e prof. Strusi; A.S. 2014/2015