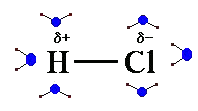 | La Ionizzazione degli Acidi |  |
| gabbia di solvatazione |
Tutti i composti molecolari polari sono allora solvatabili da solventi polari come l'acqua.
Essi sono molto numerosi e come esempio si possono citare: Acidi, Zuccheri, Alcol metilico ed etilico, ecc...
Qui vediamo una molecola di Acido Cloridrico solvatata
|
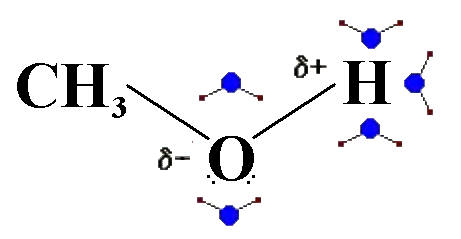
Qui vediamo una molecola di Alcool Metilico solvatata
|
Si osservi che il Metile (CH3-) non è solvatato perchè apolare.
Le molecole d'acqua sono gli "alieni blu" con "antennine rosse" disposti intorno ad essa, in modo da presentare sempre l'estremità di segno opposto.
|
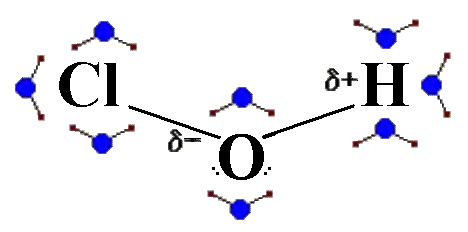
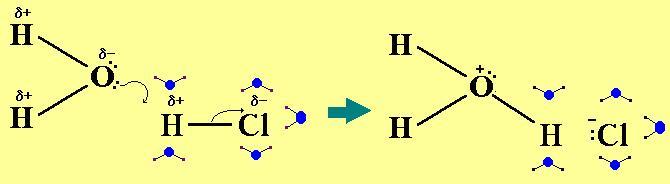
Come si può vedere dall'illustrazione più giù riprodotta, l'ossigeno di una molecola di acqua, la più vicina, presta uno dei suoi doppietti elettronici liberi all'idrogeno dell'acido H-Cl, spingendo così l'idrogeno acido a rompere il suo legame con Cl; in questo modo si formano
due ioni: lo ione idronio H3O+ e lo ione cloruro Cl-; si attua così la
| ionizzazione dell'acido cloridrico |
cioè l'acido cloridrico si scinde in uno ione positivo, lo ione idronio H3O+ e uno ione negativo, lo ione cloruro.
Questo meccanismo si realizza per qualunque acido e si parla sempre di ionizzazione di un acido.
A questa
|
segue la |
|
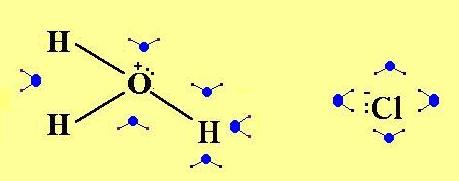
nel senso che i due ioni, formatisi inizialmente come
| coppia ionica all'interno di un'unica gabbia di solvatazione, |
si separano,
| venendo solvatati in due distinte gabbie di solvatazione |
che si muovono all'interno della soluzione in modo indipendente.
HCl + H2O  H3O+ + Cl-
H3O+ + Cl-